《自然》子刊:太狡猾!科学家发现癌细胞转移的新机制,当它们感到太拥挤,就会打造转移通道 | 科学大发现
本文获“奇点网”授权转载
要是癌症不会扩散和转移,还叫什么万病之王。
为什么这么说呢?大家可以想一下,要是癌症不会扩散、转移,就算让它使劲长,不也就是个瘤子么。放疗、化疗、靶向治疗、免疫治疗,大不了一刀下去连根切了,再长再切,还能咋地。
所以说癌症不可怕,转移才可怕。肿瘤细胞是否会转移,一直是区分肿瘤是良性还是恶性的关键指标,同时也是预测患者生存期的重要因素[1]。有资料显示,90%的癌症患者死亡都是由于癌细胞转移所导致的[2]。
癌细胞一旦随着血液或淋巴进行扩散、转移,就会像种子一样在身体其它部位“安营扎寨”,并迅速生长,这个时候治疗起来可就没那么容易了,而且目前并没有专门的药物能够抑制癌细胞转移。
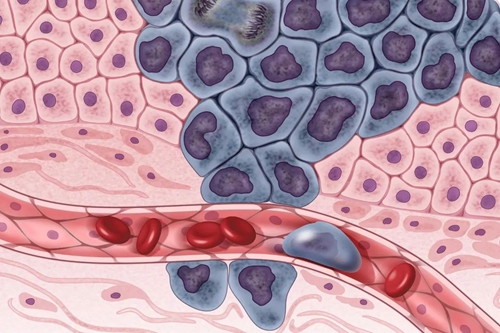
“乳腺癌在转移”
我们不禁要问,到底是谁在“指挥”着癌细胞的“扩张殖民”?如果找到了触发癌细胞转移的原始条件,是不是就能够将癌症扼杀在良性肿瘤的摇篮里呢?
就在不久前,加利福尼亚大学圣地亚哥分校的生物工程师和生物信息学家们发现了肿瘤周围环境的变化是如何引发癌细胞转移行为的。简单来说,研究人员发现当肿瘤细胞处于受限制的拥挤环境中时,会开启一组特定的基因(CINP),导致形成类似于血管的结构。这样的一个通道,不仅便于血液流动到肿瘤以提供“粮草”,更关键的是为癌细胞传播到远方提供了的机会。相关研究成果发表在《自然通讯》中[3]。
过去在临床中人们已经观察注意到了这些血管样结构的存在,而且证实这种现象的出现,与一些最具侵袭性的癌症密切相关。只是一直以来科学家们并不明白是什么触发了这个转变。
加州大学圣地亚哥分校生物工程学教授、也是本次研究的负责人Stephanie Fraley说:“过去我们都盯着肿瘤的生长研究,但是对癌症转移的了解还不够充分。”而这项研究让我们对癌细胞如何启动转移过程有了更深的认识,尤其是开启的这个基因模块的发现,或许能够帮助科学家们找到阻止转移启动的靶点,并能够预测癌症患者是否可能发生积极转移,以帮助患者和医生采取更适合的治疗策略。
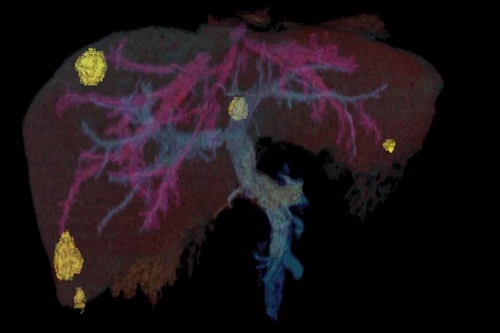
肝脏CT扫描显示出的结肠直肠癌肝转移,黄色为肿瘤
转移性肿瘤(metastatic cancer)通常也被称为IV期癌症或晚期癌症。它是癌细胞从原始癌灶中“出走”,通过血管或淋巴管扩散到身体的另一部分,形成的新肿瘤。附近的淋巴结是癌症转移最常见的地方,当然,癌细胞也倾向于扩散到肝脏、大脑、肺或者骨骼。
有趣的是,每种类型的癌症往往会扩散到某些特定的器官。比如最危险的皮肤癌黑色素瘤,经常会转移到大脑和肺部,而前列腺癌则常转移到骨骼。
更有趣的是,即使在癌症侵入另一个器官之后,它的“旗号”仍然是由它“起家”的地方决定的。例如,结肠癌扩散到肝脏后形成的肿瘤,就与原发性肝癌不一样,只能被称为是结肠癌肝转移或继发性肝癌;再比如,乳腺癌扩散到肺部后,仍然像乳腺癌,而不像肺癌。
在很多情况下,一个人如果已经接受了对原始肿瘤的治疗,癌症还是可能会复发、扩散,而且目前也没有可靠的方法来预防癌症是否会发生转移。防止癌症转移发生的最好方法,就是在原发肿瘤很小时将它们清除,这也是为什么癌症筛查如此重要的原因。
但是,即使癌症早期被检测到并被移除,肿瘤细胞也可能已经在血液和淋巴管中循环,或者隐藏在身体的其他部位。转移瘤的出现,可能是在第一次治疗数月后,也可能在数年之后。在这期间,人们往往不知道癌症还在“潜伏”,当发现明显的转移性肿瘤症状时,这个时候也就用到了那两个能让时间凝固的字——晚期。
所以,科学家们也一直想要弄清楚,肿瘤“远征军”与“根据地”之间是如何“协作关联”,以及远征在外的转移癌细胞如何在身体其他部位“传播”和“生根”的,近年来这些问题也已经成为癌症研究领域的重点研究内容。
今年5月份的时候,也是《自然通讯》,发表了一篇耶鲁大学华人科学家Rong Fan博士团队的研究,研究人员发现,当原发病灶内太拥挤时,癌细胞会分泌两种细胞因子,白细胞介素6(IL-6)和白细胞介素8(IL-8),以指导部分癌细胞进行扩散和转移。
这个研究揭示出肿瘤微环境的变化对癌细胞转移的重要影响。以我们对正常细胞的认识会觉得,当细胞周围环境变得拥挤时,细胞的增殖和传播也就会受限,但没想到“拥挤”的条件竟然触发了转移的发生。
在最近的这项研究中,研究人员也观察到了类似的现象。首先研究人员将恶性肿瘤细胞放入他们专门制作的3D胶原基质中进行观察,结果发现只有细胞在由短纤维和小孔(与长纤维和大孔相对,即高密度基质)构成的基质包围时,才会形成癌细胞相互连接的网状结构,类似血管形成的早期阶段,而低密度基质中的癌细胞和正常细胞均未形成这种网状结构。并且这种现象与基质的其他物理特征如硬度无关。
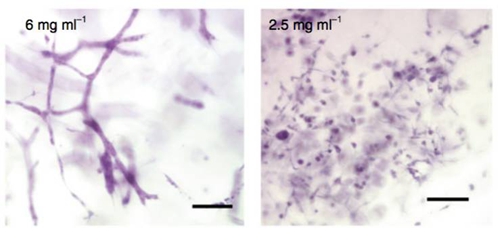
高密度的3D胶原基质环境(左)使得癌细胞产生类似血管形成的早期阶段
说到这就不得不插一嘴研究人员使用的3D胶原基质,说白了就是一个能让癌细胞立体生长的培养基,与以往实验室里用的单层细胞培养(也就是2D的)相比,这样的培养基与体内生长环境更加接近。
关键是研究人员也做了传统的培养基实验,结果发现单层的癌细胞再拥挤,组织中也没有类似血管的结构。于是,研究人员也就认为,将细胞包围在模拟人体内发生的3D环境中是至关重要的。至于之前在传统培养基中进行的癌细胞实验,如果结果不好,有可能是选错了培养基(呃。。。这。。。)
培养基究竟是3D的好还是2D的好,这里暂且按下不表。我们接着来看诡异的血管样结构的出现。这种类似血管的结构,为什么会出现?又是怎样形成的呢?
经过进一步的分析,研究人员发现,导致癌细胞行为改变的根本原因,是由一组称为CINP(collagen-induced network phenotype)的70个调控细胞迁移和血管生成相关基因的开启所引起。当把癌细胞感受到一个拥挤的受限制的环境后,癌细胞的基因表达发生了重写。Fraley说,“这几乎就像是基质环境编码了这个基因模块一样”。
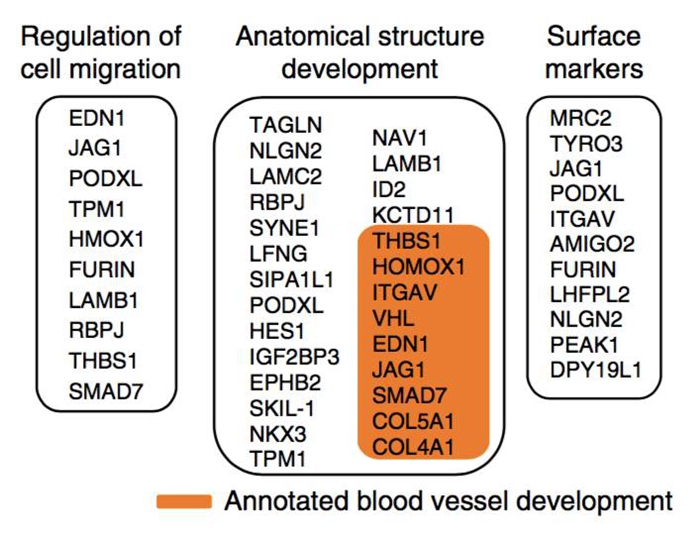
与观察到表型相关的基因列表,左:调节细胞迁移的基因;中:调节结构发育的基因,橙色标出为与血管生成相关基因;右:表面标记基因
究竟这个发现,是不是在癌症患者中客观存在的呢?
于是研究人员尝试在人类癌细胞基因表达和组织学数据库中寻找这种基因模块,结果在显示血管生成拟态(VM)表型的患者肿瘤切片中,发现了该基因模块转录的证据,并且通过对超过3000例各类实体瘤患者的VM组织学荟萃分析证实,VM表型的存在与多种类型的肿瘤(如肺癌、胶质瘤、胰腺癌、肾上腺皮质瘤、膀胱尿路上皮肿瘤等)预后较差有关。
这也就意味着,利用这个基因模块的基因,或许能够预测患者的预期寿命,以及包括乳腺癌、肺癌、胰腺癌和肾癌在内的9种癌症是否会发生转移。研究人员表示,如果肿瘤转移的可能性非常低,那么验证这个基因模块的预后价值有助于避免患者长期放疗和化疗的副作用。
当然,更重要的是研究人员接下来要在动物试验和人体数据库中进行测试,以寻找合适的分子靶点,来阻止癌细胞转移的启动。
参考资料:
[1].Nathanson S D. Insights into the mechanisms of lymph node metastasis[J]. Cancer, 2003, 98(2): 413-423.
[2].Chaffer C L, Weinberg R A. A perspective on cancer cell metastasis[J]. Science, 2011, 331(6024): 1559-1564.
[3]Velez, D.O., et al., 3D collagen architecture induces a conserved migratory and transcriptional response linked to vasculogenic mimicry. Nat Commun, 2017. 8(1): p. 1651.
[4].Demou, Z.N. and M.J. Hendrix, Microgenomics profile the endogenous angiogenic phenotype in subpopulations of aggressive melanoma. J Cell Biochem, 2008. 105(2): p. 562-73.
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号