《自然》重磅:中科院科学家首次揭开PD-1蛋白降解机制,白介素-2可促进该过程,增强T细胞抗癌能力
本文获“奇点网”授权转载,版权归“奇点网”所有,任何转载需获得“奇点网”授权。
提起肿瘤免疫治疗,离不开PD-1。咱们知道这个蛋白给免疫系统踩了刹车,让癌细胞有机可乘,那么除了直接用单抗拮抗,还有没有其他的办法能干掉它呢?
今日的《自然》杂志上刊登了一项“全华班”的重磅成果,来自中科院生物化学与细胞生物学研究所的许琛琦课题组揭示了PD-1经泛素化降解的通路,确定了一个关键酶FBXO38,并描述了其在调节T细胞抗癌功能中的作用[1]。
在人类肿瘤组织和癌症小鼠模型中,FBXO38转录水平均有所下降,添加IL-2则能恢复转录水平从而下调PD-1,这很有希望带来新的PD-1通路疗法!

许琛琦
俗话说知己知彼百战不殆,想要干掉PD-1,搞清楚它是怎么来的、又是怎么没的,显然是很有必要的。
研究者们首先尝试着观察了T细胞表面PD-1的动态变化。嗯?很奇怪,当T细胞被激活2天之后,PD-1水平达到巅峰,随后便开始缓缓下降,又过了2天便回复到最初的水平了;但是表达PD-1的PDCD1基因的转录水平并不是这样,下降幅度和蛋白水平完全不成正比!所以研究者猜测,除了自然的“生老病死”之外,PD-1应该还有其他的在蛋白水平上的调节方式!
事实上,当研究者用免疫印迹法去寻找蛛丝马迹的时候就发现,PD-1在外周血单核细胞和Jurkat细胞中存在泛素化!
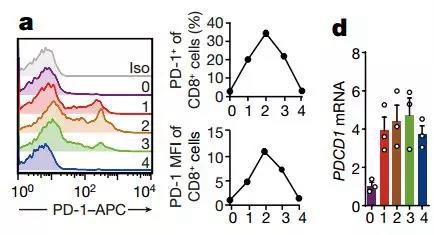
可见蛋白变化和RNA完全不在一条线上
这个泛素化,一下说起来还有点复杂。泛素是一类普遍存在的调节蛋白,能够在一系列特殊酶的作用下给细胞中不同的蛋白质进行不同的修饰,这个过程就叫泛素化。泛素化对蛋白的调节有很重要的作用,其中在特定位点上的泛素化会直接将蛋白带向被蛋白酶体降解的道路,这个过程还有个很诗意的外号“molecular kiss of death”。
泛素化主要有三大步,泛素激活酶E1激活泛素分子,把泛素转移到泛素结合酶E2上,E2再与泛素连接酶E3共同识别靶蛋白。这三步中,E3是关键的识别模块,所以说如果PD-1存在泛素化降解,那么必然存在一个只认知PD-1的E3蛋白。

泛素化过程
最终研究者从100多个可能的E3分子中筛选出来的就是FBXO38了,它是SCF蛋白家族的一员,这是一类靶向膜蛋白的泛素连接酶[2-4]。
好,就让我们来看看这个FBXO38到底有多大能量!
研究者在小鼠中选择性敲除了T细胞的FBXO38基因,并且检查了T细胞的各种生理状况。嗯,看起来似乎还好,没了这个基因,T细胞的发育还是挺正常的,外周血中的T细胞种类、数量都很稳定并没有受到影响。
T细胞的功能也没有因此损伤,T细胞受体(TCR)和CD28水平以及被激活后的反应都和正常T细胞一样。
研究者随后检查了一系列的免疫检查点,PDCD1的转录水平倒是不受影响,但是在CD8+和CD4+T细胞中,PD-1水平都增加了!这好像是PD-1独有的现象,另外一个检查点LAG-3就没有这样的变化。
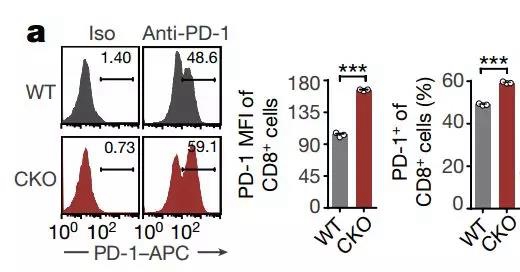
敲除FBXO38之后PD-1明显变多了
研究者还尝试给小鼠们移植了黑色素瘤和结直肠癌,结果敲除了FBXO38的小鼠明显肿瘤进展更快,肿瘤浸润T细胞中PD-1水平更高,虽然T细胞的种类和数量都不受影响,但是这些T细胞明显增殖能力受损、分泌细胞因子也减少了。
这样的T细胞,怕是打不过肿瘤了吧!研究者分别给黑色素瘤小鼠输了缺少FBXO38和正常的T细胞。考虑到现实情况不会一点儿FBXO38都没有,所以这次的T细胞是用发卡RNA处理的,FBXO38表达降低了50%以上。
这批被敲低FBXO38的T细胞明显战力不足。虽然看着都是一样的TCR、一样的CD28,但是来到与肿瘤的近身战就原形毕露了,表面PD-1水平增加,增殖能力也下降了。
这些足以证明,FBXO38可以通过调节PD-1水平来影响T细胞的抗肿瘤能力。
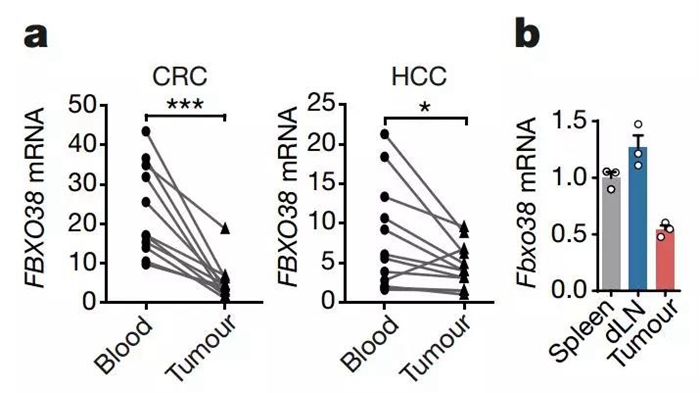
日常都还好,一到肿瘤身边就怂了(。)
这个现象在临床上也有迹可循。对人类肿瘤组织的分析显示,肿瘤微环境中的PD-1+T细胞明显比外周更多,它们FBXO38转录明显更低。
此前有科学家认为,纵然有肿瘤作为抗原给予刺激,但是在肿瘤微环境中缺乏协同刺激和细胞因子,实际上T细胞是得不到充分的激活的[5],或许这能够解释为什么FBXO38转录降低。
那就多给点刺激!研究者尝试了多种细胞因子,发现独独白介素-2(IL-2)能够显著增加T细胞中的FBXO38转录,降低细胞表面PD-1水平。进一步分析显示,IL-2主要激活的转录因子STAT5正好直接与FBXO38的启动子结合!
其实以前也有临床研究发现,IL-2对转移黑色素瘤和肾癌有治疗作用,但是机制一直都搞不清楚[6-8],另外一组学者则发现IL-2可以抑制慢性感染模型中T细胞表面的的PD-1[9],看起来真相就是和FBXO38以及PD-1有关啦!
考虑到IL-2是抗癌界老兵了,不知道是不是可以迅速开展相关研究呢?针对FBXO38也大有文章可做,PD-1看你往哪跑!
参考资料:
[1]https://www.nature.com/articles/s41586-018-0756-0
[2] Li, C.-W. et al. Glycosylation and stabilization of programmed death ligand-1 suppresses T-cell activity. Nat. Commun. 7, 12632 (2016).
[3] Zhao, J. et al. F-box protein FBXL19-mediated ubiquitination and degradation of the receptor for IL-33 limits pulmonary infammation. Nat. Immunol. 13, 651–658 (2012).
[4] Skaar, J. R., Pagan, J. K. & Pagano, M. SCF ubiquitin ligase-targeted therapies. Nat. Rev. Drug Discov. 13, 889–903 (2014).
[5] Sharma, P. & Allison, J. P. The future of immune checkpoint therapy. Science 348, 56–61 (2015).
[6] Krieg, C., Létourneau, S., Pantaleo, G. & Boyman, O. Improved IL-2 immunotherapy by selective stimulation of IL-2 receptors on lymphocytes and endothelial cells. Proc. Natl Acad. Sci. USA 107, 11906–11911 (2010).
[7] Zhu, E. F. et al. Synergistic innate and adaptive immune response to combination immunotherapy with anti-tumor antigen antibodies and extended serum half-life IL-2. Cancer Cell 27, 489–501 (2015).
[8] Rosenberg, S. A. IL-2: the frst efective immunotherapy for human cancer. J. Immunol. 192, 5451–5458 (2014).
[9] West, E. E. et al. PD-L1 blockade synergizes with IL-2 therapy in reinvigorating exhausted T cells. J. Clin. Invest. 123, 2604–2615 (2013).
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号