赵锦华-2017级-硕士

- 联系: (QQ) 2503378726
- 母校:成都中医药大学
- 时间:2017.9-
- 川大攻读博士2021
近日,国际知名期刊ACS Applied Materials & Interfaces(IF:8.758)在线发表课题组的最新研究成果——Development of a Tau-Targeted Drug Delivery System Using a Multifunctional Nanoscale Metal–Organic Framework for Alzheimer’s Disease Therapy (ACS Applied Materials & Interfaces 2020, 12, 40, 44447-44458, DOI: 10.1021/acsami.0c11064)。该文章被选为该期刊2020年12卷40期的封面文章。

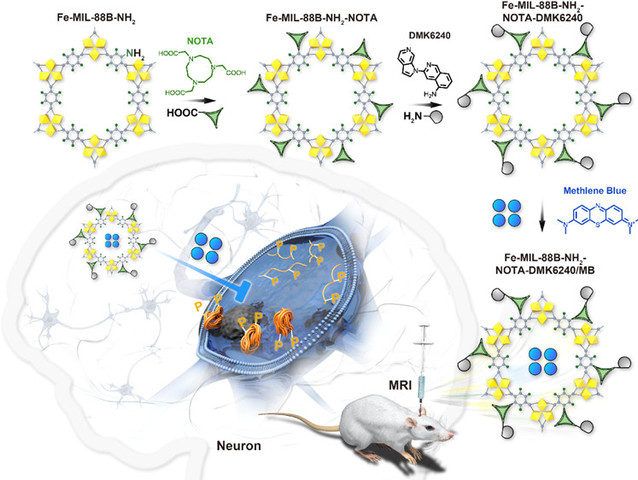
阿尔茨海默病(Alzheimer’s disease,AD)是一种常见的神经退行性疾病,主要表现为记忆缺失,语言能力下降和认知功能障碍。目前,AD仍然无法治愈,主要归因于AD发病机理不明确以及对疾病诊断困难。AD的发病机制相关假说及靶点较多,越来越多研究表明Tau蛋白的病理发展与AD的认知功能高度相关。随着纳米技术的发展,新型功能材料能够实现对疾病同时诊断和治疗。因此,针对Tau通路构建一个新型的药物递送系统用于AD的治疗和诊断具有重要研究意义。纳米金属有机框架(Nanoscale Metal Organic Frameworks, NMOFs)因具有多种优势在生物医药领域应用广泛,如均匀可调的孔径,高负载能力,可控的药物释放动力学和改善的生物相容性等。
我们选择NMOF磁性材料Fe-MIL-88B-NH2为载体,通过酰胺缩合反应在其表面进行功能化修饰,用1,4,7-三氮杂环壬烷-1,4,7-三乙酸(NOTA)将靶向Tau蛋白试剂5-氨基-3-(吡咯并[2,3-c]吡啶-1-基)异喹啉(Defluorinated MK6240,DMK6240)连接于Fe-MIL-88B-NH2表面,用来增强该系统对磷酸化Tau蛋白的靶向作用,最后将Tau蛋白聚集抑制剂——亚甲蓝(Methylene Blue,MB)——封装在该系统中,该系统不仅能递送药物,还可作为核磁成像造影剂。通过XRD、IR、TGA、SEM等方法对该体系的组成、形貌等特征进行了表征。通过高内涵、MRI、Morris水迷宫等体内外实验证明,Fe-MIL-88B-NH2-NOTA-DMK6240是优良的T2加权核磁成像造影剂,Fe-MIL-88B-NH2-NOTA-DMK6240/MB可以像“导弹”一样定点释放MB,抑制磷酸化Tau的聚集,保护神经元,最终改善AD的症状。