首发链接:https://www.x-mol.com/news/453442
恭喜方方!
众所周知,细胞中离子浓度的稳定性对于维持细胞基本功能是至关重要的。离子浓度梯度不仅可以作为细胞的蓄电池为细胞提供能量,并且可以通过微调来控制细胞繁殖、分化以及信号传递。离子通道是细胞内运输离子的最重要的蛋白,它们镶嵌在细胞膜以及细胞器的磷脂双分子层上,通过高度的可控性以及离子选择性来的实现离子高效运输与调控。很多疾病,例如毛纤维囊肿、癫痫甚至肿瘤的发生都和离子通道的异常有关。利用人工合成的小分子来替代失调的离子通道为这类疾病的治疗提供了极大的可能性。
由于其潜在的医用价值,人工离子运输体的研发一直以来都备受关注。近几十年来,人们报道了许多具有离子运输功能的小分子,然而绝大多数分子的离子运输(尤其是阳离子,如钾、钠离子)功能研究都仅限于脂质体内,这在很大程度上限制了这些分子在细胞内甚至活体上的应用。近期香港大学晨兴化学生物学实验室杨丹课题组开发了一个基于氨氧基酸的新型抗癌小分子,很好地弥补了上述缺陷,有效地实现了人工离子载体在线粒体及溶酶体内进行钾离子/氢离子交换,从而可以选择性地杀死卵巢癌干细胞。

在肿瘤中,癌细胞并不是均一的,有一小群细胞叫做癌症干细胞,它们虽然只占肿瘤的很少一部分,却被认为是肿瘤的种子,它们不只可以自我增殖,同时可以源源不断地分化成癌症细胞。并且这类细胞具有极高的耐药性,据报道,最常用的化疗(如使用紫杉醇)或者放射疗法虽然可以大幅度地减小肿瘤的体积,但是癌症干细胞却可以继续生存,甚至被富集,从而导致癌症复发、转移以及最终病人的死亡。
在该项研究中,作者创新性地在氨氧基酸的氮端引入3,5-双三氟甲基苯甲酰基,使氨氧基NH的pKa值降至7.0。在生理pH下,通过去质子化,该分子形成烯醇式结构,提供了钾离子的结合位点,协助钾离子穿透脂质双分子层。在酸性条件下,这一分子重新质子化,释放钾离子,完成一次钾离子和氢离子的置换。
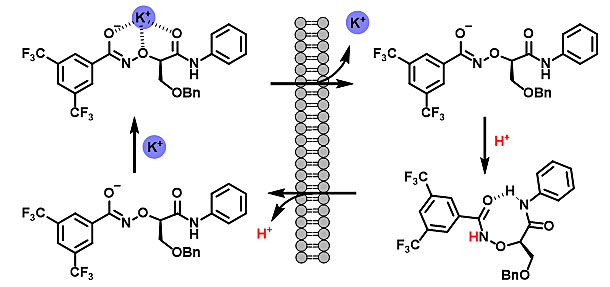
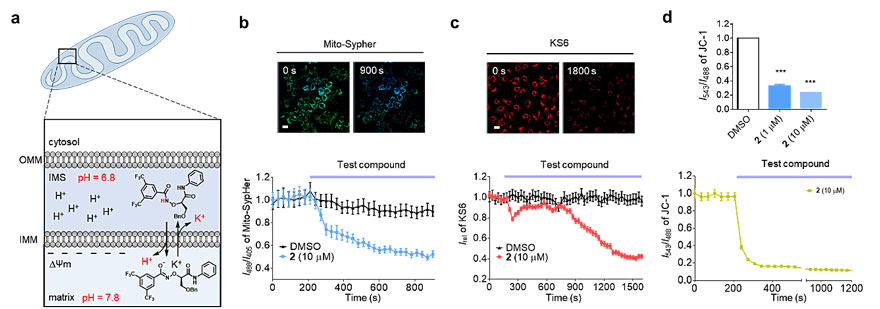
作者发现该分子可以有效地利用细胞内的氢离子浓度梯度,从而选择性地在线粒体和溶酶体进行钾离子和氢离子运输。人工离子载体通过打破线粒体离子平衡,导致线粒体膜电位去极化,产生超氧,打断呼吸链作用,并最终引发细胞凋亡。同时,溶酶体酸度失调,阻断了细胞自噬过程。由于和普通癌细胞相比,卵巢癌干细胞更加依赖线粒体产生ATP,最终导致肿瘤干细胞死亡而不影响健康细胞的活性。
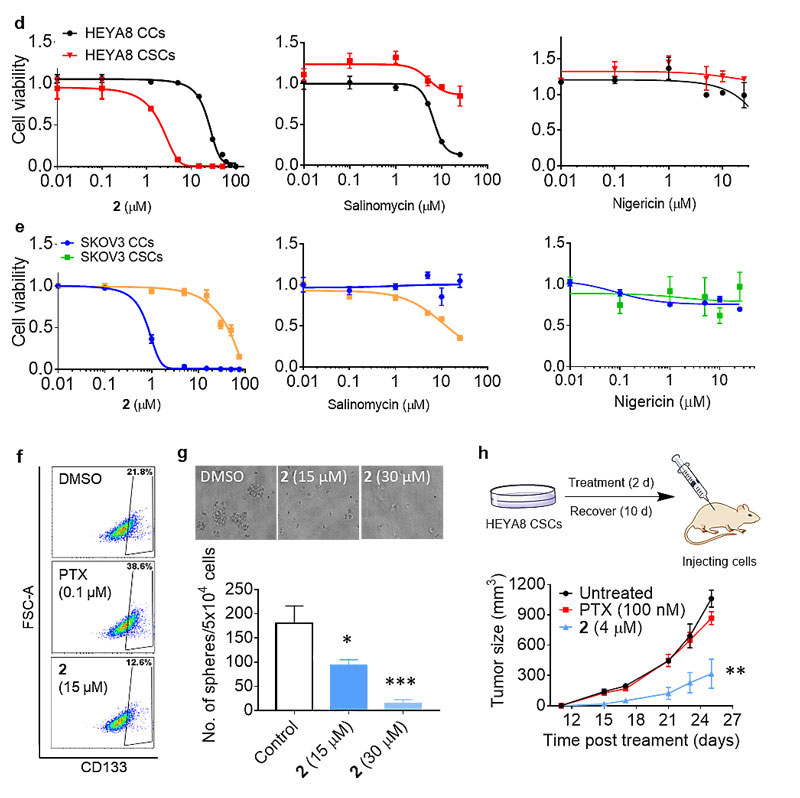
该篇发表在Journal of the American Chemical Society 上的工作给癌症抗药性、肿瘤转移以及其他钾离子通道相关疾病的治疗提供了新的指导价值。香港大学杨丹教授为文章通讯作者,沈方方博士为该文章的第一作者,戴晟遥、黄乃琪和邓珊亦为本研究作出贡献。香港大学生物系黃思齐教授课题组在卵巢癌干细胞及动物实验方面提供了重要帮助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Mediating K+/H+ Transport on Organelle Membranes to Selectively Eradicate Cancer Stem Cells by a Small Molecule
Fang-Fang Shen, Sheng-Yao Dai, Nai-Kei Wong, Shan Deng, Alice Sze-Tsai Wong, Dan Yang*
J. Am. Chem. Soc., 2020, DOI: 10.1021/jacs.0c02134
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
