超越双螺旋!科学家首次证实人体细胞内存在C-C配对的4链DNA结构,或与衰老、癌症有关
本文获“奇点网”授权转载,版权归“奇点网”所有,任何转载需获得“奇点网”授权。
我们对人体的认知一直不停地被刷新。
如果没有意外的话,我们的分子生物学教材可能又要修改了。
科学家对生理条件下人体的DNA结构又有了新的发现。之前认为不可能存在于人体内的、违反常识的DNA二级结构,澳大利亚Garvan医学研究所的研究人员在人体内看到了[1]。这项研究成果刊登在了近期的《自然化学》上。

1953年,在历经多年的努力之后,沃森和克里克提出DNA右手双螺旋结构模型[2],解开生命之秘,开启了分子生物学时代。他们之所以能提出双螺旋结构,是因为他们发现,在自然界中腺嘌呤(A)是与胸腺嘧啶(T)配对的,鸟嘌呤(G)是与胞嘧啶(C)配对的。正是这种稳定可靠的碱基互补配对原则,让双螺旋结构有了根基。
不过,就在沃森和克里克领走诺奖没多久,一些科学家在实验室发现了不寻常的现象:在那些富含GC的DNA区域,本该互补配对的G和C,在特定的实验条件下牵起了同类的“手”,变成了G和G配对,C和C配对。
这种违反碱基互补配对原则的配对方式,让DNA有了非比寻常的的结构。DNA单链上的G和G配对,就形成了G-四链体(G-quadruplex)[3,4];C与C配对,则构成了i-motif[5,6]。
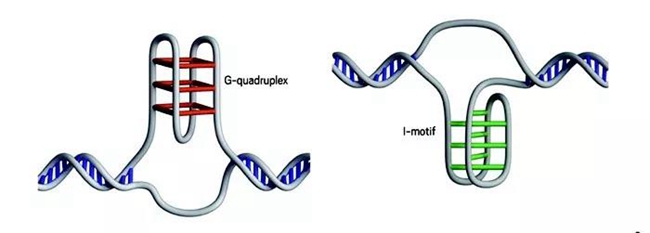
神奇的G-四链体(左:红色的闲连接的是G)
和i-motif(右:绿色的线连接的是C)
二者结构相似,但又决然不同
稍有分子生物学基础的人,不难想到:根据DNA双螺旋结构的碱基互补配对原则,如果一条链能形成G-四链体,那么只要条件合适,它对面的那条链理论上就可以形成i-motif。
不过一直以来科学家都是在细胞外且特定的实验条件下才能发现它们。例如,形成稳定的G-四链体需要环境中有充足的锂离子、钠离子或者钾离子[7];而i-motif的形成需要一个偏酸性的环境;而且神奇的是,它能随着环境酸碱度的变化,快速形成和展开[8,9]。
那么,它们这种随周遭环境变化的能力有什么用?人体会形成这种结构吗?如果有,对人体有啥影响?
如果你拿着G-四链体和i-motif的DNA序列,与人基因组对比一遍,就不难发现,在人体基因组内至少有30万个DNA片段可以形成G-四链体和i-motif序列[10]。
其中,40%基因的调控区含有能形成G-四链体和i-motif的DNA序列,巧的是,癌基因的启动子区域尤甚[11]。科学家已经证实,在特定的条件下Rb[12]、RET[13]、VEGF[14]、c-Myc[15]和bcl-2[16]等癌基因的启动子区域可以形成G-四链体和i-motif。
以癌基因bcl-2为例。有研究认为,如果bcl-2基因的启动子里形成了G-四链体和i-motif,会阻断抑制bcl-2基因表达的蛋白与bcl-2基因启动子结合,这就促进了癌基因bcl-2的表达,导致癌症的形成或进展[17,18]。
此外,端粒DNA也有形成G-四链体和i-motif的能力[19]。

端粒中形成G-四链体和i-motif会阻碍端粒的延长,加速细胞衰老
不过一直以来,科学家缺少可以直接在细胞内检测G-四链体和i-motif结构的手段。因此,虽然他们知道G-四链体和i-motif长啥样,也知道人体有形成二者的DNA序列,就是没办法证实人体内确实存在。
毕竟在生理条件下,碱基配对是要遵循碱基互补配对原则的。达不到特定的条件,是不能形成G-四链体和i-motif的。
本次,澳大利亚Garvan医学研究所的Marcel E. Dinger和Daniel Christ团队找到了一个可以特异性结合i-motif的荧光抗体。有了这个抗体,研究人员就可以将细胞里的i-motif尽收眼底。

Marcel E. Dinger(左)和Daniel Christ(右)
有了这样神器,研究人员发现,i-motif结构基本都分布在人体的细胞核里,无论是健康细胞还是细胞。通过分析一个与端粒长度有关基因的i-motif结构,研究人员在细胞内证实,i-motif结构缺失存在于基因表达的调节区域。
此外,他们还发现i-motifs大多形成于细胞“生命周期”的第一阶段G1期,此时细胞代谢旺盛,开始合成细胞生长需要的各种蛋白质等物质。于此同时,他们发现在此期间,i-motif结构会不停的出现、消失。因此,研究人员认为,i-motif的极有可能通过形成和展开,控制基因的开和关。
在文章的前面已经介绍过,i-motif的形成和展开与周围环境的酸碱度变化有关。Dinger和Christ团队也在人体细胞内证实了这个现象。
之前的研究表明,细胞内的酸碱度变化与培养液的二氧化碳含量是负相关的,即培养基的二氧化碳含量越高,细胞内的pH越低,酸性越强。于是,研究人员希望通过改变二氧化碳浓度,研究i-motif的形成与展开。
研究人员将特定细胞株系放置在培养液二氧化碳浓度分别为2%(pH=7.98±0.1)、5%(pH=7.51±0.07)和8%(pH=7.28±0.08)的环境中培养。一段时间后观察细胞核内的荧光位点数量,就可以知道环境酸碱度对i-motif形成的影响。
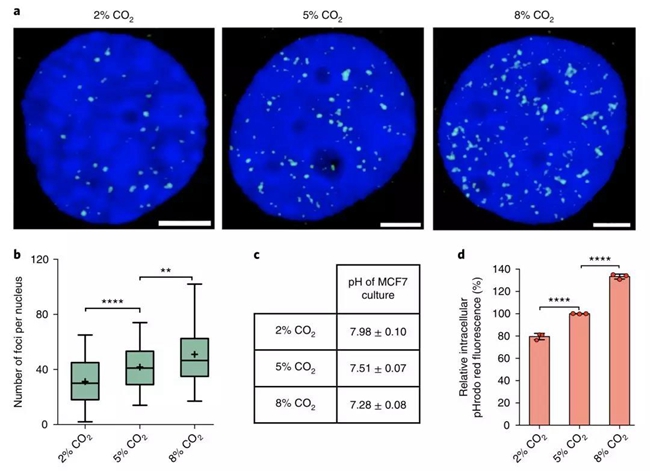
不同二氧化碳浓度下细胞核中的i-motif结构数量比较
毫无意外,研究人员发现,与二氧化碳浓度为5%的培养液相比,二氧化碳浓度为2%的培养液培养出来的细胞,含i-motif的DNA位点少了20%左右;二氧化碳浓度为8%的培养液培养出来的细胞,含i-motif的DNA位点多了30%左右。
这意味着,细胞周围环境的酸碱度越低,i-motif结构越多。之前有研究表明,癌细胞内的pH值在7.2左右,癌细胞外的pH值在6.7-7.1之间[20]。所以,理论上癌细胞的DNA里面有很多的i-motif结构。癌细胞内外的这种酸碱环境,对i-motif结构有影响吗?会进一步影响癌症的发展吗?还需要更深入的研究证实。
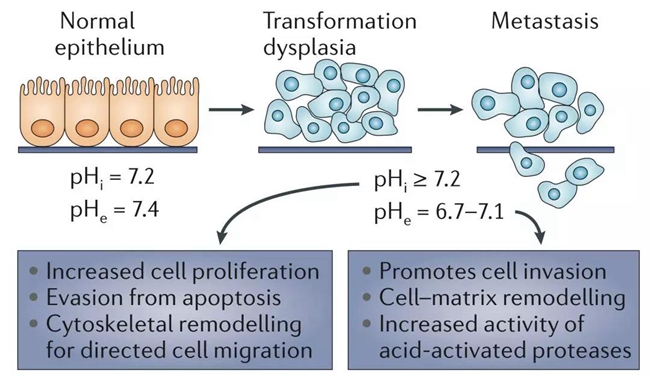
癌细胞内外的pH值,与癌细胞行为之间的关系
总的来说,澳大利亚Garvan医学研究所的研究团队筛选到了一个特异性极强的抗体,首次在人体内看到了能够快速响应酸碱度变化的i-motif结构,也初步证明它分布于很多癌基因,以及端粒的调控区。暗示i-motif结构与癌症和衰老有一定的联系,而且这个联系可能与细胞周围的酸碱性动态变化有关。实际上,G-四链体已经在2013年就被剑桥大学证实在人体内存在[21],目前科学家正在针对性的开展抗癌药物研发工作。
毋庸置疑,这个研究让我们对生命有了新的认知,也为疾病等的研究打开了一个新的方向。不过,这种结构对人体影响究竟如何,还需要更多的研究去探索。好在Dinger和Christ团队已经给我们提供了一个还不错的工具。
参考资料:
[1]. Mahdi Zeraati, David B. Langley, et al. I-motif DNA structures are formed in the nuclei of human cells.[J]. Nature Chemistry, 2018.
[2]. Watson J D, Crick F. Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid.[J]. Nature, 1953, 171(4356): 737-738.
[3]. Gellert M, Lipsett M N, Davies D R, et al. HELIX FORMATION BY GUANYLIC ACID[J]. Proceedings of the National Academy of Sciences of the United States of America, 1962, 48(12): 2013-2018.
[4]. Sen D, Gilbert W. Formation of parallel four-stranded complexes by guanine-rich motifs in DNA and its implications for meiosis[J]. Nature, 1988, 334(6180): 364-366.
[5]. Inman R B. Transitions of DNA homopolymers[J]. Journal of molecular biology, 1964, 9(3): 624-637.
[6]. Gehring K, Leroy J, Gueron M, et al. A tetrameric DNA structure with protonated cytosine.cytosine base pairs.[J]. Nature, 1993, 363(6429): 561-565.
[7]. Millevoi S, Moine H, Vagner S, et al. G-quadruplexes in RNA biology.[J]. Wiley Interdisciplinary Reviews - Rna, 2012, 3(4): 495-507.
[8]. Jin K S, Shin S R, Ahn B, et al. pH-Dependent Structures of an i-Motif DNA in Solution[J]. The Journal of Physical Chemistry B, 2009, 113(7): 1852-1856.
[9]. Benabou S, Avino A, Eritja R, et al. Fundamental aspects of the nucleic acid i-motif structures[J]. RSC Advances, 2014, 4(51): 26956-26980.
[10]. Huppert J L, Balasubramanian S. Prevalence of quadruplexes in the human genome[J]. Nucleic acids research, 2005, 33(9): 2908-2916.
[11]. Huppert J L, Balasubramanian S. G-quadruplexes in promoters throughout the human genome[J]. Nucleic acids research, 2006, 35(2): 406-413.
[12]. Xu Y, Sugiyama H. Formation of the G-quadruplex and i-motif structures in retinoblastoma susceptibility genes (Rb)[J]. Nucleic acids research, 2006, 34(3): 949-954.
[13]. Guo K, Pourpak A, Beetz-Rogers K, et al. Formation of pseudosymmetrical G-quadruplex and i-motif structures in the proximal promoter region of the RET oncogene[J]. Journal of the American Chemical Society, 2007, 129(33): 10220-10228.
[14]. Guo K, Gokhale V, Hurley L H, et al. Intramolecularly folded G-quadruplex and i-motif structures in the proximal promoter of the vascular endothelial growth factor gene[J]. Nucleic acids research, 2008, 36(14): 4598-4608.
[15]. Sun D, Hurley L H. The importance of negative superhelicity in inducing the formation of G-quadruplex and i-motif structures in the c-Myc promoter: implications for drug targeting and control of gene expression[J]. Journal of medicinal chemistry, 2009, 52(9): 2863-2874.
[16]. Kendrick S, Akiyama Y, Hecht S M, et al. The i-motif in the bcl-2 P1 promoter forms an unexpectedly stable structure with a unique 8: 5: 7 loop folding pattern[J]. Journal of the American Chemical Society, 2009, 131(48): 17667-17676.
[17]. Seto M, Jaeger U, Hockett R D, et al. Alternative promoters and exons, somatic mutation and deregulation of the Bcl‐2‐Ig fusion gene in lymphoma[J]. The EMBO journal, 1988, 7(1): 123-131.
[18]. Heckman C, Mochon E, Arcinas M, et al. The WT1 Protein Is a Negative Regulator of the Normalbcl-2 Allele in t (14; 18) Lymphomas[J]. Journal of Biological Chemistry, 1997, 272(31): 19609-19614.
[19]. Leroy J L, Gueron M, Mergny J L, et al. Intramolecular folding of a fragment of the cytosine-rich strand of telomeric DNA into an i-motif[J]. Nucleic acids research, 1994, 22(9): 1600-1606.
[20].Webb B A, Chimenti M S, Jacobson M P, et al. Dysregulated pH: a perfect storm for cancer progression.[J]. Nature Reviews Cancer, 2011, 11(9): 671-677.
[21].Biffi G, Tannahill D, Mccafferty J, et al. Quantitative visualization of DNA G-quadruplex structures in human cells[J]. Nature Chemistry, 2013, 5(3): 182-186.
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号