【研究背景】
纳米活性氧(ROS)发生器在微环境选择性细胞敏化和肿瘤治疗领域潜力巨大,具有单原子催化位点的纳米酶系统(SAC)是该类体系的典型代表。然而,在高粘度、高生物物质浓度的生理体系中,有限的催化活性位点的三维可接近性,以及颗粒内部底物、短寿命自由基产物、氧化损伤靶分子的传质是限制SAC系统实际效能的重要挑战。
基于此,本课题组开发了一种新的“聚合物诱导框架材料形貌破缺”策略来制备花状SAC纳米酶,大大提高了活性位点的三维可及性。以Flower-Like Nanozymes with Large Accessibility of Single Atom Catalysis Sites for ROS Generation Boosted Tumor Therapy为题发表在《Advanced Functional Materials》杂志上,第一作者为博士研究生邢玉鑫。
【图文导读】

花状SAC纳米酶材料及其催化ROS治疗机制
该纳米平台采用沸石-咪唑骨架(ZIF)和聚多巴胺(PDA)的协同配位/聚合作为构筑路线,前者在反应中通过发挥类多酚氧化酶活性催化后者原位聚合,后者儿茶酚的竞争配位导致前者的形貌退化与二维化、表面微孔堵塞、二维纳米片结构的三维化交联,最终驱动形成花状复合结构。进而,通过高温炭化,得到具有高暴露Zn-N4位点、大瓣间孔空间(~39 nm)、高比表面积(388 m2 g−1)、超高金属原子负载量(27.3 wt%)的SAC纳米酶(C-NFs)。此外,PDA的保护作用促进纳米花瓣(7 nm厚度)中微孔的重新开放和大量缺陷介孔(~4 nm)的形成,以上因素能有效促进底物和产物在纳米结构内部的传质与运输。

聚合物诱导框架材料形貌破缺和纳米花结构调控
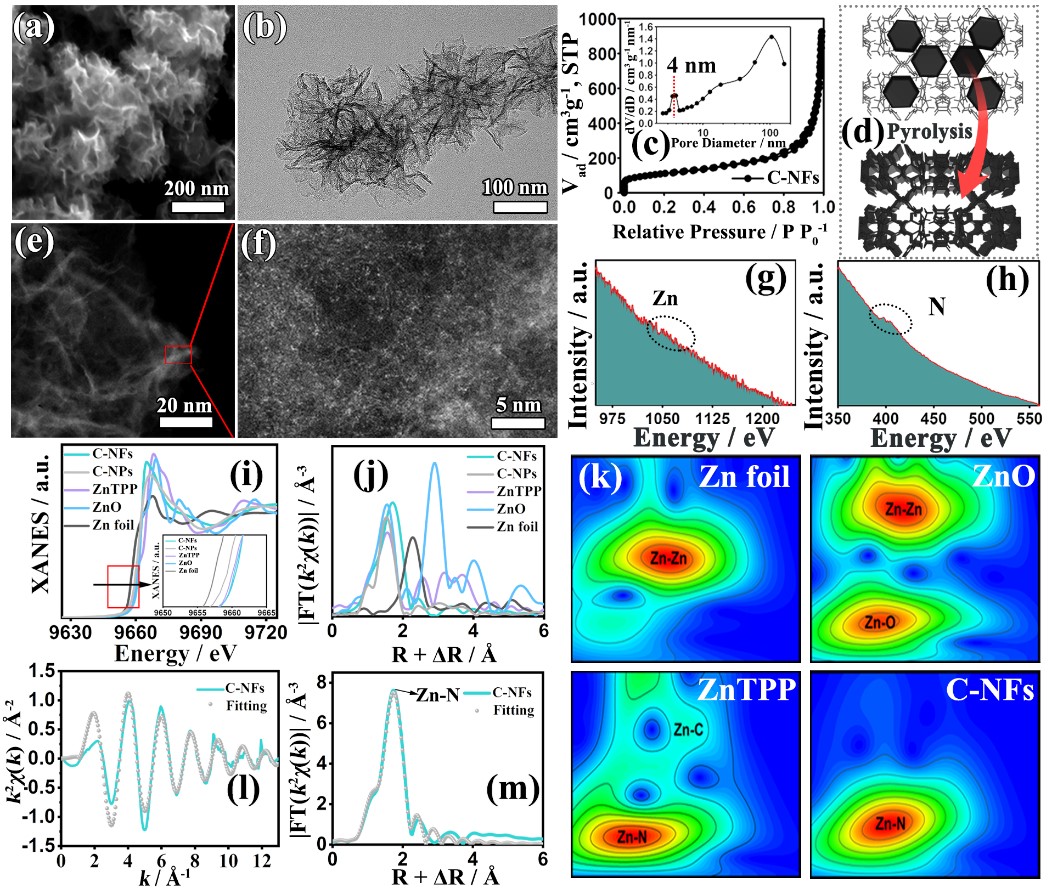
碳化后花状纳米酶的结构分析和单原子催化位点表征
由于具有高密度高可及性的单原子催化位点,该材料展现出优越的类过氧化物酶活性,与颗粒形貌和大小的ZIF-8衍生的SAC材料相比,其转换频率TOF(0.293 s-1)增加36.6倍,能在弱酸性环境中高效促进羟基自由基的产生和生物分子(谷胱甘肽、磷脂、核酸)的氧化损伤。

花状SAC纳米酶的类过氧化物酶催化活性
此外,去铁铁蛋白(AFt)在丰富孔空间内的修饰可以解决该SAC纳米酶的水相分散性问题,还可以通过蛋白空腔负载化疗药物(DOX)。系统的体内体外研究实验结果表明,肿瘤微环境选择性的高水平ROS生成,可诱导GSH消耗、线粒体膜电势下降、Caspase-3蛋白酶上调等系统性氧化应激上升,促进肿瘤细胞(耐药乳腺癌MCF-7/ADR)抗性下降和药物治疗再敏化,从而高效杀伤耐药肿瘤。

C-NFs@AFt诱导的氧化应激和细胞凋亡的体外评估
【小结】
该平台可以大大提高纳米酶结构内催化位点的数量/可及性、底物扩散和反应动力学,以满足ROS辅助治疗的实际效果,对该类肿瘤治疗体系的设计具有启发作用。此外,关于MOF/高分子聚合相互作用在框架纳米结构调控中的影响规律,可为多孔纳米酶的开发/应用提供新思路。
【原文链接】
https://doi.org/10.1002/adfm.202111171