当前位置:
X-MOL 学术
›
Chem. Sci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Hybrid mass spectrometry methods reveal lot-to-lot differences and delineate the effects of glycosylation on the tertiary structure of Herceptin®†
Chemical Science ( IF 7.6 ) Pub Date : 2019-01-17 00:00:00 , DOI: 10.1039/c8sc05029e Rosie Upton 1 , Lukasz G Migas 1 , Kamila J Pacholarz 1 , Richard G Beniston 2 , Sian Estdale 2 , David Firth 2 , Perdita E Barran 1
Chemical Science ( IF 7.6 ) Pub Date : 2019-01-17 00:00:00 , DOI: 10.1039/c8sc05029e Rosie Upton 1 , Lukasz G Migas 1 , Kamila J Pacholarz 1 , Richard G Beniston 2 , Sian Estdale 2 , David Firth 2 , Perdita E Barran 1
Affiliation
|
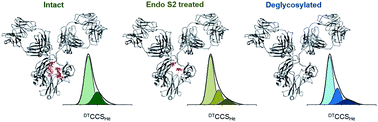
To quantify the measurable variations in the structure of a biopharmaceutical product we systematically evaluate three lots of Herceptin®, two mAb standards and an intact Fc-hinge fragment. Each mAb is examined in three states; glycan intact, truncated (following endoS2 treatment) and fully deglycosylated. Despite equivalence at the intact protein level, each lot of Herceptin® gives a distinctive signature in three different mass spectrometry approaches. Ion mobility mass spectrometry (IM-MS) shows that in the API, the attached N-glycans reduce the conformational spread of each mAb by 10.5–25%. Hydrogen/deuterium exchange mass spectrometry (HDX-MS) data support this, with lower global deuterium uptake in solution when comparing intact to the fully deglycosylated protein. HDX-MS and activated IM-MS map the influence of glycans on the mAb and reveal allosteric effects which extend far beyond the Fc domains into the Fab region. Taken together, these findings and the supplied interactive data sets establish acceptance criteria with application for MS based characterisation of biosimilars and novel therapeutic mAbs.
中文翻译:

混合质谱方法揭示批次间差异并描述糖基化对赫赛汀®三级结构的影响†
为了量化生物制药产品结构中可测量的变化,我们系统地评估了三批 Herceptin®、两种 mAb 标准品和一个完整的 Fc 铰链片段。每个 mAb 在三种状态下进行检查;聚糖完整、截短(endoS2 处理后)和完全去糖基化。尽管在完整蛋白质水平上具有等效性,但每批 Herceptin® 在三种不同的质谱方法中都给出了独特的特征。离子淌度质谱 (IM-MS) 显示,在 API 中,附着的 N-聚糖将每种 mAb 的构象扩散减少了 10.5-25%。氢/氘交换质谱 (HDX-MS) 数据支持这一点,与完整的蛋白质和完全去糖基化的蛋白质相比,溶液中整体氘的吸收量较低。 HDX-MS 和活化的 IM-MS 绘制了聚糖对 mAb 的影响,并揭示了远远超出 Fc 结构域并延伸到 Fab 区域的变构效应。总而言之,这些发现和提供的交互式数据集为生物仿制药和新型治疗性单克隆抗体基于 MS 的表征应用建立了接受标准。
更新日期:2019-01-17
中文翻译:

混合质谱方法揭示批次间差异并描述糖基化对赫赛汀®三级结构的影响†
为了量化生物制药产品结构中可测量的变化,我们系统地评估了三批 Herceptin®、两种 mAb 标准品和一个完整的 Fc 铰链片段。每个 mAb 在三种状态下进行检查;聚糖完整、截短(endoS2 处理后)和完全去糖基化。尽管在完整蛋白质水平上具有等效性,但每批 Herceptin® 在三种不同的质谱方法中都给出了独特的特征。离子淌度质谱 (IM-MS) 显示,在 API 中,附着的 N-聚糖将每种 mAb 的构象扩散减少了 10.5-25%。氢/氘交换质谱 (HDX-MS) 数据支持这一点,与完整的蛋白质和完全去糖基化的蛋白质相比,溶液中整体氘的吸收量较低。 HDX-MS 和活化的 IM-MS 绘制了聚糖对 mAb 的影响,并揭示了远远超出 Fc 结构域并延伸到 Fab 区域的变构效应。总而言之,这些发现和提供的交互式数据集为生物仿制药和新型治疗性单克隆抗体基于 MS 的表征应用建立了接受标准。





















































 京公网安备 11010802027423号
京公网安备 11010802027423号