当前位置:
X-MOL 学术
›
Exp. Mol. Med.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
诱导的心脏起搏器细胞由于其低代谢需求而在代谢压力下存活。
Experimental & Molecular Medicine ( IF 9.5 ) Pub Date : 2019-09-13 , DOI: 10.1038/s12276-019-0303-6 Jin-Mo Gu 1 , Sandra I Grijalva 2 , Natasha Fernandez 1 , Elizabeth Kim 3 , D Brian Foster 4 , Hee Cheol Cho 1, 2
Experimental & Molecular Medicine ( IF 9.5 ) Pub Date : 2019-09-13 , DOI: 10.1038/s12276-019-0303-6 Jin-Mo Gu 1 , Sandra I Grijalva 2 , Natasha Fernandez 1 , Elizabeth Kim 3 , D Brian Foster 4 , Hee Cheol Cho 1, 2
Affiliation
|
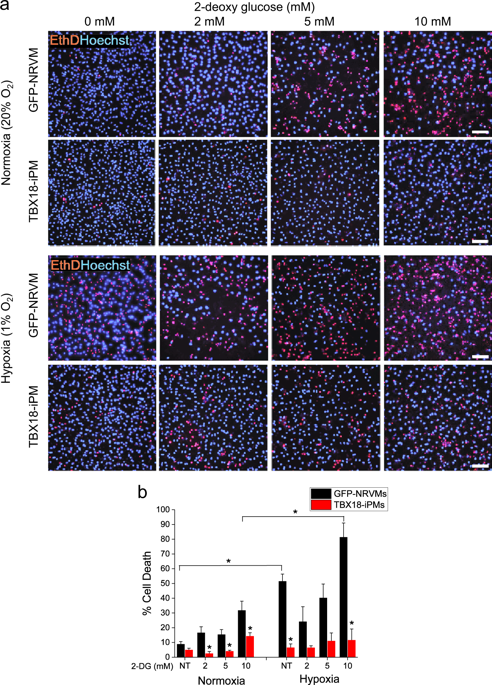
窦房结的心脏起搏细胞启动每一次心跳。与我们对其电激发成分的理解相比,对驱动起搏器肌细胞自动性的代谢基础知之甚少。这种缺乏主要是由于天然心脏起搏器肌细胞的稀缺。在这里,我们利用由 TBX18 介导的重编程 (TBX18-iPMs) 产生的诱导起搏器肌细胞来研究起搏器肌细胞和工作心肌细胞之间代谢程序的比较差异。TBX18-iPMs 对代谢应激的抵抗力更强,在氧化应激下表现出更高的细胞活力。与对照心室肌细胞相比,TBX18 诱导的起搏器肌细胞 (iPM) 消耗的氧化磷酸化程度较低,糖酵解能力较小。此外,TBX18-iPM 中的线粒体比对照中的要小。我们推断线粒体融合和裂变之间平衡的转变是导致在 TBX18-iPM 中观察到的较小线粒体的原因。我们确定了线粒体内膜融合蛋白 Opa1 作为这一过程的关键介质之一,并证明 Opa1 表达的抑制增加了 TBX18-iPM 中的同步自律率。总之,我们的数据表明 TBX18-iPM 表现出低代谢需求,与其线粒体形态和承受代谢损伤的能力相匹配。TBX18-iPMs 中的线粒体比对照中的要小。我们推断线粒体融合和裂变之间平衡的转变是导致在 TBX18-iPM 中观察到的较小线粒体的原因。我们确定了线粒体内膜融合蛋白 Opa1 作为这一过程的关键介质之一,并证明 Opa1 表达的抑制增加了 TBX18-iPM 中的同步自律率。总之,我们的数据表明 TBX18-iPM 表现出低代谢需求,与其线粒体形态和承受代谢损伤的能力相匹配。TBX18-iPMs 中的线粒体比对照中的要小。我们推断线粒体融合和裂变之间平衡的转变是导致在 TBX18-iPM 中观察到的较小线粒体的原因。我们确定了线粒体内膜融合蛋白 Opa1 作为这一过程的关键介质之一,并证明 Opa1 表达的抑制增加了 TBX18-iPM 中的同步自律率。总之,我们的数据表明 TBX18-iPM 表现出低代谢需求,与其线粒体形态和承受代谢损伤的能力相匹配。我们确定了线粒体内膜融合蛋白 Opa1 作为这一过程的关键介质之一,并证明 Opa1 表达的抑制增加了 TBX18-iPM 中的同步自律率。总之,我们的数据表明 TBX18-iPM 表现出低代谢需求,与其线粒体形态和承受代谢损伤的能力相匹配。我们确定了线粒体内膜融合蛋白 Opa1 作为这一过程的关键介质之一,并证明 Opa1 表达的抑制增加了 TBX18-iPM 中的同步自律率。总之,我们的数据表明 TBX18-iPM 表现出低代谢需求,与其线粒体形态和承受代谢损伤的能力相匹配。

"点击查看英文标题和摘要"
更新日期:2019-09-14

"点击查看英文标题和摘要"


















































 京公网安备 11010802027423号
京公网安备 11010802027423号