Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Bcl2相关的致癌基因3在新生心肌细胞的间隙连接蛋白连接蛋白43的转换中的作用。
Scientific Reports ( IF 3.8 ) Pub Date : 2019-05-21 , DOI: 10.1038/s41598-019-44139-w Farzaneh Ghasemi Tahrir 1 , Manish Gupta 1 , Valerie Myers 2, 3 , Jennifer Gordon 1 , Joseph Y Cheung 2, 4 , Arthur M Feldman 2, 3 , Kamel Khalili 1
Scientific Reports ( IF 3.8 ) Pub Date : 2019-05-21 , DOI: 10.1038/s41598-019-44139-w Farzaneh Ghasemi Tahrir 1 , Manish Gupta 1 , Valerie Myers 2, 3 , Jennifer Gordon 1 , Joseph Y Cheung 2, 4 , Arthur M Feldman 2, 3 , Kamel Khalili 1
Affiliation
|
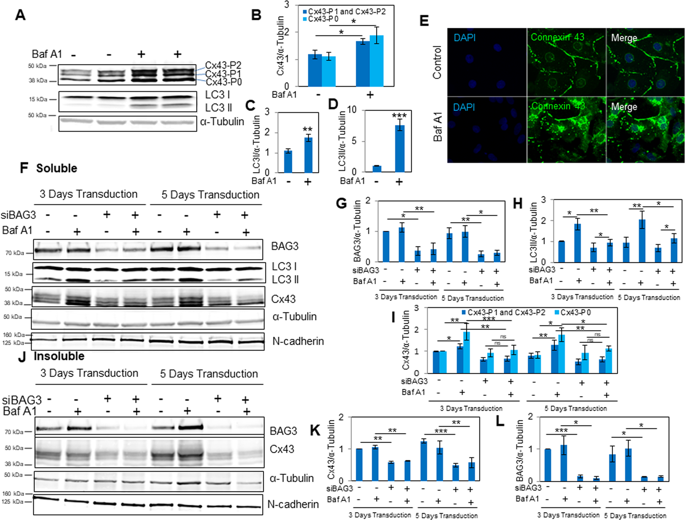
任何损害缝隙连接的主要蛋白质之一的连接蛋白43(Cx43)的表达,转换和磷酸化的病理应激都会不利地影响心肌细胞的行为,从而导致心律不齐和心力衰竭的发展。我们在原发性新生大鼠心室心肌细胞(NRVC)中的研究结果表明,自噬溶酶体途径的损伤通过抑制溶酶体活性或抑制Bcl2相关的致癌基因3(BAG3)(一种应力诱导的多效性蛋白)来异常调节Cx43的降解。通过自噬途径参与蛋白质质量控制(PQC)的蛋白质。溶酶体活性的抑制导致Cx43聚集体的积累和BAG3的抑制大大减少了Cx43的营业额。此外,BAG3的敲低通过Cx43蛋白稳定性失调降低了Cx43的水平。在压力条件下,BAG3的表达影响Cx43磷酸化的状态及其降解。此外,我们发现BAG3与细胞骨架蛋白α-微管蛋白共定位,并且α-微管蛋白解聚导致Cx43的细胞内积累。这些观察结果归因于BAG3的一种新功能,该功能涉及在正常和压力条件下控制Cx43周转,并潜在地优化通过间隙连接的心肌细胞的通讯。α-Tubulin的解聚导致Cx43的细胞内积累。这些观察结果归因于BAG3的一种新功能,该功能涉及在正常和压力条件下控制Cx43周转,并潜在地优化通过间隙连接的心肌细胞的通讯。α-Tubulin的解聚导致Cx43的细胞内积累。这些观察结果归因于BAG3的一种新功能,该功能涉及在正常和压力条件下控制Cx43周转,并潜在地优化通过间隙连接的心肌细胞的通讯。

"点击查看英文标题和摘要"
更新日期:2019-05-21

"点击查看英文标题和摘要"





















































 京公网安备 11010802027423号
京公网安备 11010802027423号