Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
N-聚糖组成对IgG1 Fc的结构和动力学的影响及其对抗体工程的意义。
Scientific Reports ( IF 3.8 ) Pub Date : 2017-Oct-04 , DOI: 10.1038/s41598-017-12830-5 Hui Sun Lee , Wonpil Im
Scientific Reports ( IF 3.8 ) Pub Date : 2017-Oct-04 , DOI: 10.1038/s41598-017-12830-5 Hui Sun Lee , Wonpil Im
|
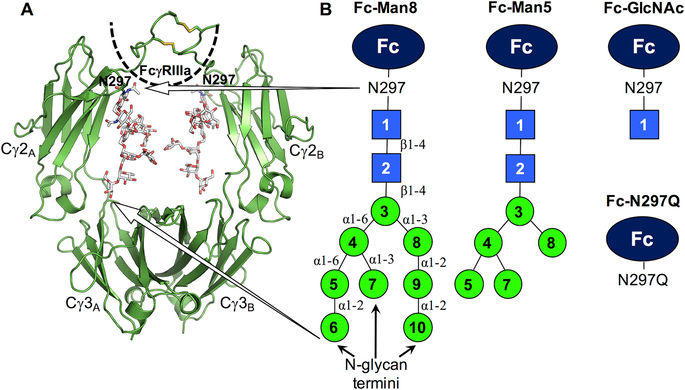
免疫球蛋白G1(IgG1)是人类血清抗体的一类,是开发用于治疗人类疾病的单克隆抗体的最广泛使用的支架。天冬酰胺(N)297连接的聚糖的组成可调节IgG1 Fc对Fcγ受体的结合亲和力,但尚不清楚位于结合界面远端的N-聚糖末端的结构修饰如何促进亲和力。通过一系列连续截短的高甘露糖IgG1 Fc糖型的原子分子动力学模拟,我们发现C'E环和Cγ2-Cγ3方向是高度动态的,并且N-聚糖组成的变化改变了它们的构象整体。与截短的糖型相比,高甘露糖型的糖型优先采样与FcγRIIIa结合更有效的构象,提示IgG1 Fc N-聚糖在优化与Fc受体的界面以有效结合中的作用。轨迹分析还揭示了N-聚糖具有大幅度的运动,并且碳水化合物部分在Fc结合形式和未结合形式之间相互转化,使得能够对聚糖末端进行酶促修饰。

"点击查看英文标题和摘要"
更新日期:2017-10-04

"点击查看英文标题和摘要"





















































 京公网安备 11010802027423号
京公网安备 11010802027423号