Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Peroxynitrite-Free Nitric Oxide-Embedded Nanoparticles Maintain Nitric Oxide Homeostasis for Effective Revascularization of Myocardial Infarcts
ACS Nano ( IF 15.8 ) Pub Date : 2024-11-15 , DOI: 10.1021/acsnano.4c10118 Jiaxiong Zhang, Shuya Wang, Quan Sun, Jian Zhang, Xiaojing Shi, Meilian Yao, Jing Chen, Qiong Huang, Guogang Zhang, Qun Huang, Kelong Ai, Yongping Bai
ACS Nano ( IF 15.8 ) Pub Date : 2024-11-15 , DOI: 10.1021/acsnano.4c10118 Jiaxiong Zhang, Shuya Wang, Quan Sun, Jian Zhang, Xiaojing Shi, Meilian Yao, Jing Chen, Qiong Huang, Guogang Zhang, Qun Huang, Kelong Ai, Yongping Bai
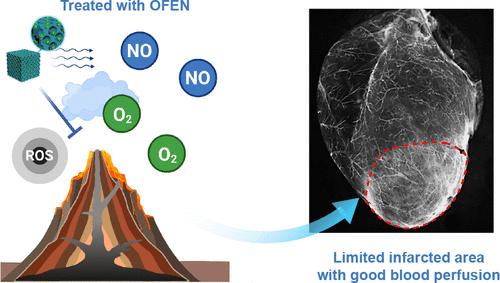
|
Revascularization is crucial for treating myocardial infarction (MI). Nitric oxide (NO), at an appropriate concentration, is recognized as an ideal and potent pro-angiogenic factor. However, the application of NO in the treatment of MI is limited. Improper NO supplementation is harmful to revascularization because NO is converted into harmful peroxynitrite (ONOO–) in MI tissues with high reactive oxygen species (ROS) levels. We overcome these obstacles by embedding biliverdin and NO into Prussian blue (PB) nanolattices to obtain an ONOO–-free NO-embedded nanomedicine (OFEN). Unlike previous NO donors, OFEN provides NO stably and spontaneously for a longer time (>7 days), which makes it possible to maintain a stable concentration of NO, suitable for angiogenesis, through dose optimization. More importantly, based on the synergy between PB and biliverdin, OFEN converts ROS into beneficial O2 and inhibits the production of ONOO– from the source. OFEN specifically targets MI tissues and achieves sustained and stable NO delivery at the MI site. OFEN effectively promotes revascularization in the MI tissue, significantly reduces myocardial death and fibrosis, and ultimately promotes the complete recovery of cardiac function. Our strategy provides a promising approach for the treatment of myocardial and other ischemic diseases.
中文翻译:

不含过氧亚硝酸盐的一氧化氮包埋纳米颗粒维持一氧化氮稳态,有效修复心肌梗死
血运重建对于治疗心肌梗死 (MI) 至关重要。适当浓度的一氧化氮 (NO) 被认为是一种理想且有效的促血管生成因子。然而,NO 在 MI 治疗中的应用是有限的。NO 补充不当对血运重建有害,因为 NO 在活性氧 (ROS) 水平高的 MI 组织中转化为有害的过氧亚硝酸盐 (ONOO–)。我们通过将胆绿素和 NO 包埋到普鲁士蓝 (PB) 纳米晶格中来克服这些障碍,以获得不含 ONOO 的 NO 包埋纳米药物 (OFEN)。与以前的 NO 供体不同,OFEN 稳定且自发地提供 NO 的时间更长 (>7 天),这使得通过剂量优化可以维持适合血管生成的 NO 浓度稳定。更重要的是,基于 PB 和胆绿素之间的协同作用,OFEN 将 ROS 转化为有益的 O2,并从源头上抑制 ONOO– 的产生。OFEN 特异性靶向 MI 组织,并在 MI 部位实现持续稳定的 NO 递送。OFEN 有效促进 MI 组织中的血运重建,显着减少心肌死亡和纤维化,最终促进心脏功能的完全恢复。我们的策略为治疗心肌和其他缺血性疾病提供了一种有前途的方法。
更新日期:2024-11-15
中文翻译:

不含过氧亚硝酸盐的一氧化氮包埋纳米颗粒维持一氧化氮稳态,有效修复心肌梗死
血运重建对于治疗心肌梗死 (MI) 至关重要。适当浓度的一氧化氮 (NO) 被认为是一种理想且有效的促血管生成因子。然而,NO 在 MI 治疗中的应用是有限的。NO 补充不当对血运重建有害,因为 NO 在活性氧 (ROS) 水平高的 MI 组织中转化为有害的过氧亚硝酸盐 (ONOO–)。我们通过将胆绿素和 NO 包埋到普鲁士蓝 (PB) 纳米晶格中来克服这些障碍,以获得不含 ONOO 的 NO 包埋纳米药物 (OFEN)。与以前的 NO 供体不同,OFEN 稳定且自发地提供 NO 的时间更长 (>7 天),这使得通过剂量优化可以维持适合血管生成的 NO 浓度稳定。更重要的是,基于 PB 和胆绿素之间的协同作用,OFEN 将 ROS 转化为有益的 O2,并从源头上抑制 ONOO– 的产生。OFEN 特异性靶向 MI 组织,并在 MI 部位实现持续稳定的 NO 递送。OFEN 有效促进 MI 组织中的血运重建,显着减少心肌死亡和纤维化,最终促进心脏功能的完全恢复。我们的策略为治疗心肌和其他缺血性疾病提供了一种有前途的方法。


















































 京公网安备 11010802027423号
京公网安备 11010802027423号