当前位置:
X-MOL 学术
›
ACS Macro Lett.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Inhibition of α-Synuclein Misfolding into β-Sheet Domains on Medium-Sized Gold Nanoclusters: Evidence from Enhanced Sampling MD Simulations
ACS Macro Letters ( IF 5.1 ) Pub Date : 2024-10-22 , DOI: 10.1021/acsmacrolett.4c00533 Shuai Gong, Guanbin Gao, Taolei Sun, Lei Shen
ACS Macro Letters ( IF 5.1 ) Pub Date : 2024-10-22 , DOI: 10.1021/acsmacrolett.4c00533 Shuai Gong, Guanbin Gao, Taolei Sun, Lei Shen
|
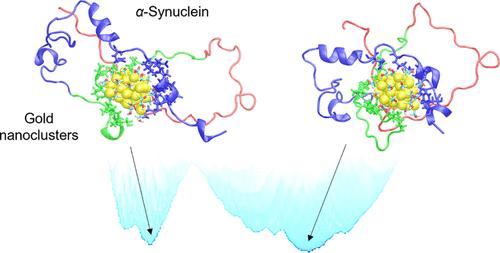
Targeting Parkinson’s disease (PD) related protein, α-synuclein (αS), via gold nanoclusters (AuNCs) has received considerable attention in PD treatments, but its molecular basis on the initial interactions between αS and AuNCs remains elusive due to the absence of a unique secondary structure of αS chains. Here, at the single-cluster level, we incorporate well-tempered metadynamics simulations to explore the structural and thermodynamic characteristics of the full length αS adsorbed on different-sized AuNCs (Aun, n = 25, 36, 44, 68, 102) with modeled thiolated ligands (Aun@Lig). The conformational landscapes of αS indicate that uncharged Aun@SCH2OH chaperones the native intrinsically disordered conformations of αS, while negatively and positively charged AuNCs greatly increase the likelihood of forming intramolecular β-sheet domains, which are necessary for αS fibrillation and are a hallmark of PD. The binding details further demonstrate the significant inhibitory effect of the medium-sized Au36@SCH2OH on αS misfolding into β-sheet domains. This provides a valuable guideline for customizing AuNCs to precisely manipulate protein folding and misfolding behaviors, with potential implications for disease treatments.
中文翻译:

抑制中型金纳米簇上 α-突触核蛋白错误折叠成 β 片结构域:来自增强采样 MD 模拟的证据
通过金纳米簇 (AuNCs) 靶向帕金森病 (PD) 相关蛋白 α-突触核蛋白 (αS) 在 PD 治疗中受到了相当大的关注,但由于缺乏 αS 链的独特二级结构,其关于 αS 和 AuNCs 之间初始相互作用的分子基础仍然难以捉摸。在这里,在单簇水平上,我们结合了调和的元动力学模拟,以探索吸附在不同大小的 AuNCs (Aun, n = 25, 36, 44, 68, 102) 上的全长 αS 的结构和热力学特性与建模的硫醇化配体 (Aun@Lig)。αS 的构象景观表明,不带电的 Aun@SCH2OH 陪伴 αS 的天然固有无序构象,而带负电荷和带正电荷的 AuNC 大大增加了形成分子内 β 折叠结构域的可能性,这是 αS 纤化所必需的,也是 PD 的标志。结合细节进一步表明,中等大小的 Au36@SCH 2OH 对错误折叠成 β 片结构域的 αS 具有显著的抑制作用。这为定制 AuNC 以精确操纵蛋白质折叠和错误折叠行为提供了有价值的指南,对疾病治疗具有潜在意义。
更新日期:2024-10-22
中文翻译:

抑制中型金纳米簇上 α-突触核蛋白错误折叠成 β 片结构域:来自增强采样 MD 模拟的证据
通过金纳米簇 (AuNCs) 靶向帕金森病 (PD) 相关蛋白 α-突触核蛋白 (αS) 在 PD 治疗中受到了相当大的关注,但由于缺乏 αS 链的独特二级结构,其关于 αS 和 AuNCs 之间初始相互作用的分子基础仍然难以捉摸。在这里,在单簇水平上,我们结合了调和的元动力学模拟,以探索吸附在不同大小的 AuNCs (Aun, n = 25, 36, 44, 68, 102) 上的全长 αS 的结构和热力学特性与建模的硫醇化配体 (Aun@Lig)。αS 的构象景观表明,不带电的 Aun@SCH2OH 陪伴 αS 的天然固有无序构象,而带负电荷和带正电荷的 AuNC 大大增加了形成分子内 β 折叠结构域的可能性,这是 αS 纤化所必需的,也是 PD 的标志。结合细节进一步表明,中等大小的 Au36@SCH 2OH 对错误折叠成 β 片结构域的 αS 具有显著的抑制作用。这为定制 AuNC 以精确操纵蛋白质折叠和错误折叠行为提供了有价值的指南,对疾病治疗具有潜在意义。


















































 京公网安备 11010802027423号
京公网安备 11010802027423号