Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
ZFAND5激活26S蛋白酶体的分子机制
Molecular Cell ( IF 14.5 ) Pub Date : 2023-08-17 , DOI: 10.1016/j.molcel.2023.07.023 Donghoon Lee 1 , Yanan Zhu 2 , Louis Colson 3 , Xiaorong Wang 4 , Siyi Chen 3 , Emre Tkacik 3 , Lan Huang 4 , Qi Ouyang 5 , Alfred L Goldberg 1 , Ying Lu 3
Affiliation
|
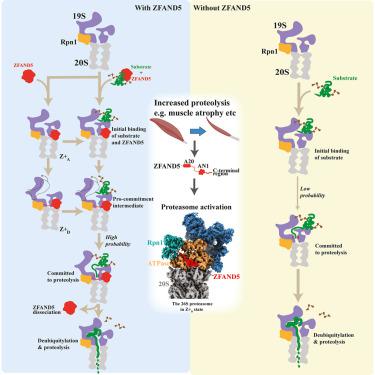
各种激素、激酶和压力源(禁食、热休克)都会刺激 26S 蛋白酶体活性。为了了解其降解泛素化蛋白质的能力如何增强,我们研究了小鼠 ZFAND5,它在肌肉萎缩期间促进蛋白质降解。冷冻电镜显示 ZFAND5 诱导 19S 调节颗粒发生较大的构象变化。 ZFAND5 的 AN1 Zn 指结构域与 Rpt5 ATPase 相互作用,其 C 末端与 Rpt1 ATPase 和 Rpn1(泛素结合亚基)相互作用。蛋白酶体结合后,ZFAND5 会加宽底物易位通道的入口,但它仅与蛋白酶体短暂结合。 ZFAND5 的解离随后刺激 20S 蛋白酶体门的打开。使用单分子显微镜,我们发现 ZFAND5 结合泛素化底物,延长其与蛋白酶体的结合,并增加结合底物发生降解的可能性,即使 ZFAND5 在底物去泛素化之前解离。蛋白酶体构象和反应周期的这些变化可以解释加速降解,并表明其他蛋白酶体激活剂如何刺激蛋白水解。

"点击查看英文标题和摘要"





















































 京公网安备 11010802027423号
京公网安备 11010802027423号