丰产金属铜催化不对称氢化非对称邻溴取代二芳基酮
作者:X-MOL
2024-09-22
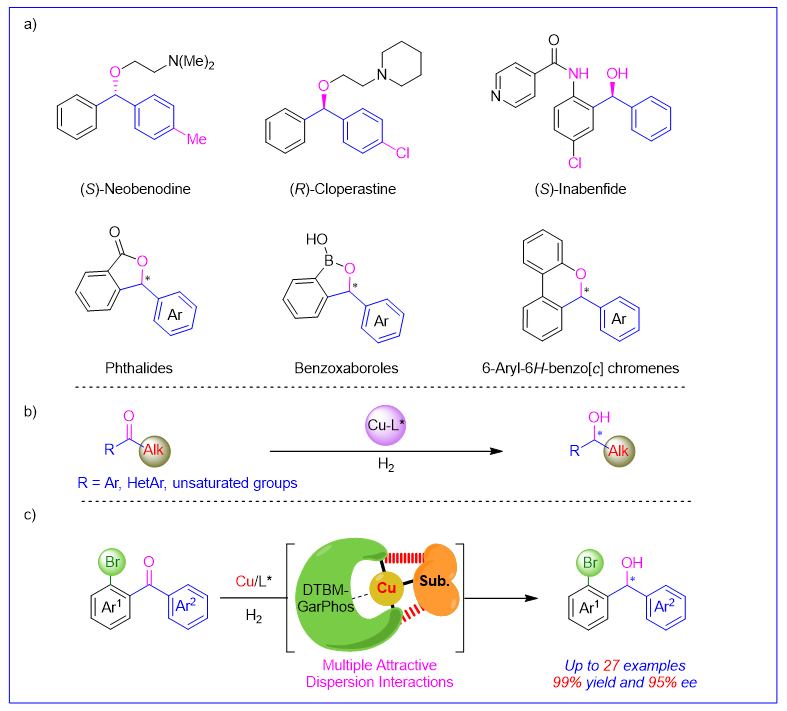
手性二芳基醇骨架是许多药物和天然活性化合物合成中的重要结构单元(Figure 1a)。例如,(S )-新苯海拉明、(R )-氯哌斯汀、(S )-抗倒胺等。因此,开发高效简洁的不对称合成手性二芳基醇的方法引起了化学研究者的极大兴趣。目前,不对称合成手性二芳基醇的策略大致分为三种方法:1) 酶催化的二芳基酮不对称还原;2) 亲核试剂对芳香醛的亲核加成;3) 过渡金属催化剂对二芳基酮进行不对称还原。由于Cu(I)-H催化氢化活性较低,因此铜催化的不对称氢化反应研究相对滞后。到目前为止,只报道了少数底物的铜催化不对称氢化反应(Figure 1b)。通常,在二芳基酮的邻位引入卤素基团既可以增强手性催化剂的识别能力也可以方便的脱除和衍生。最近,作者发现了CH···HC多重吸引色散相互作用(MADI)的协同催化效应,可以显著地提高不对称氢化的反应性和立体选择性。作者设想这一策略也可以应用于铜催化的具有挑战性的非对称二芳基酮的不对称氢化(Figure 1c)。
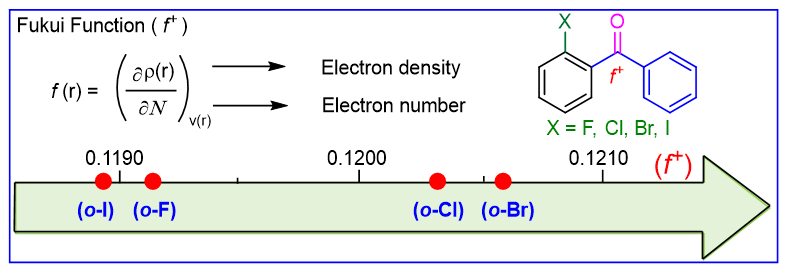
Figure 1. a) Representative active molecules bearing chiral benzhydrol skeletons; b) Cu-catalyzed asymmetric hydrogenation of ketones; c) Cu-catalyzed asymmetric hydrogenation of unsymmetrical benzophenones. 上海交通大学 化学化工学院张万斌 教授(点击查看介绍 )团队长期致力于过渡金属催化的不对称氢化研究,并发现了催化剂与底物之间 CH···HC 弱吸引相互作用的协同催化效应,该作用也被称为多重色散相互作用(MADI)。利用该策略成功开发出系列不对称催化氢化反应 (稀有金属:Pd : Angew. Chem. Int. Ed. 2013 , 52 , 11632; Angew. Chem. Int. Ed. 2016 , 55 , 8444; Nature Commun . 2018 , 9 , 5000; iScience 2020 , 23 , 100960; Rh : Angew. Chem. Int. Ed . 2019 , 58 , 11505; Ru : J. Am. Chem. Soc. 2024 , 146 , doi/10.1021/jacs.4c09794; 丰产金属:Ni : Angew. Chem. Int. Ed . 2019 , 58 , 7329; Angew. Chem. Int. Ed . 2020 , 59 , 5371; Nat. Commun . 2020 , 11 , 5935; Nat. Chem . 2022 , 14 , 920; Angew. Chem. Int. Ed . 2023 , 62 , e202214990;Co : Angew. Chem. Int. Ed . 2019 , 58 , 15767; Angew. Chem. Int. Ed . 2021 , 59 , 16989; Cu : Angew. Chem. Int. Ed . 2023 , 62 , e202306380)。近日,利用该策略,他们成功开发了一例基于MADI效应的铜催化不对称氢化非对称邻溴取代二芳基酮反应,得到了一系列易于衍生的手性二芳基醇产物,并取得了优异的反应结果。 最初为了确定一个合适的邻位取代卤素基团,作者计算了Fukui函数(f + o -F、Cl、Br和I,见Figure 2)中羰基碳原子亲电性的指标。结果显示,邻位溴(o -Br)取代的二芳基酮具有最高的Fukui函数值(0.1206),因此,邻位溴(o -Br)取代基被选作二芳基酮底物中的对映导向官能团。
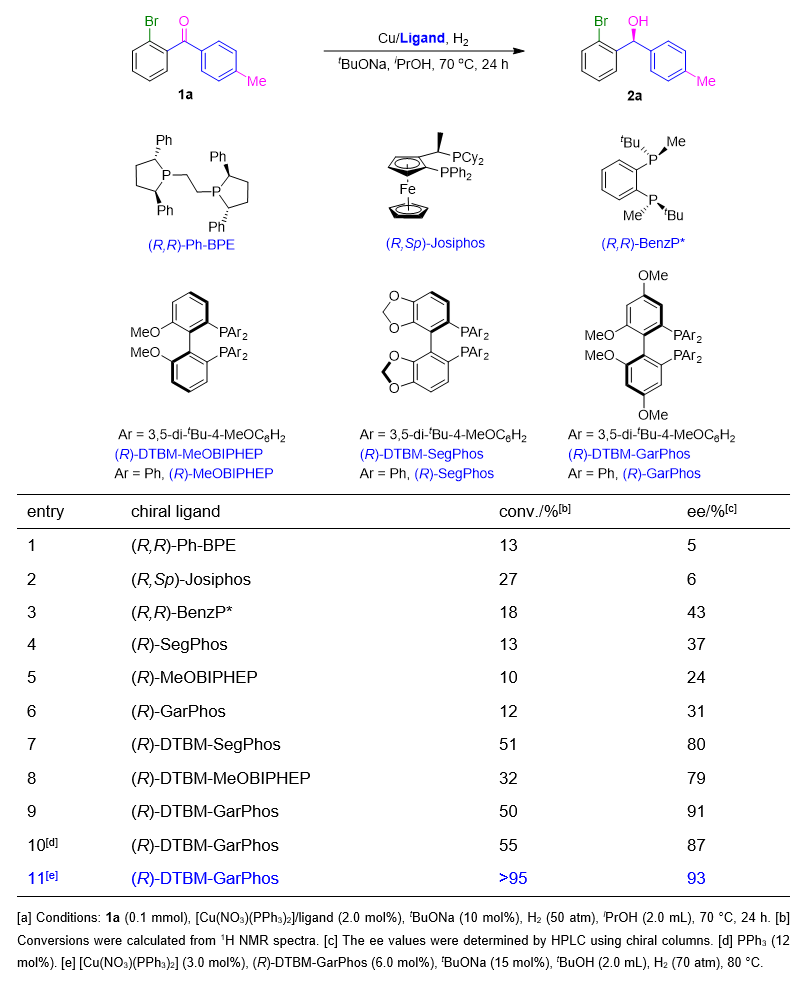
Figure 2. Fukui function(f + ortho -halobenzophenones. 接下来,作者对于包括配体、铜盐、碱、溶剂、反应温度、H 2 H 2 Table 1 . Optimization of reaction conditions. [a]
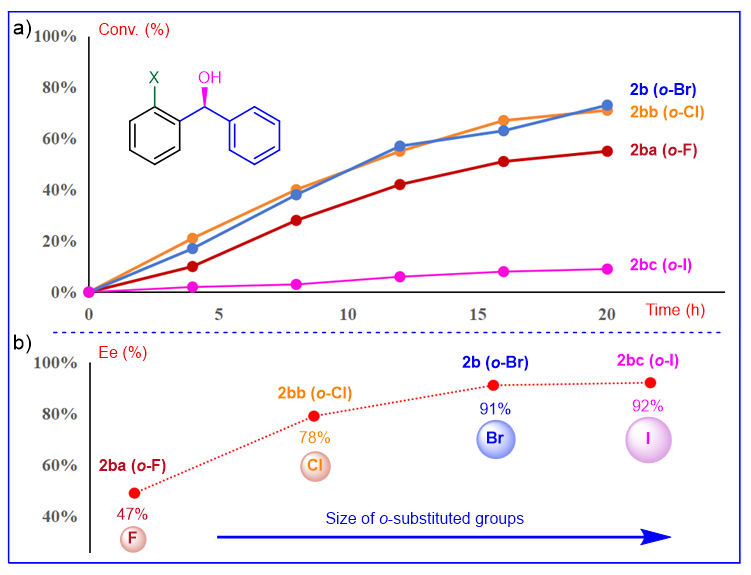
为了进一步验证氢化反应与邻位取代基团之间的关系,作者使用底物1b 、1ba-1bc 进行了动力学实验(Figure 3a)。首先观察到,它们的转化总体趋势与Fukui函数预测的值相吻合(Scheme 2),尽管邻位Cl和Br取代的底物在转化率上表现出差异相对较小,以及轻微的波动。这表明底物中羰基碳的亲电性的增强在提高氢化反应性方面起着重要作用。此外,作者还确定了相应产物的对映选择性(Figure 3b,邻位F、Cl、Br和I取代的产物:分别为47%、78%、91%和92% ee),产物的对映选择性与邻位取代基团的大小呈正相关。
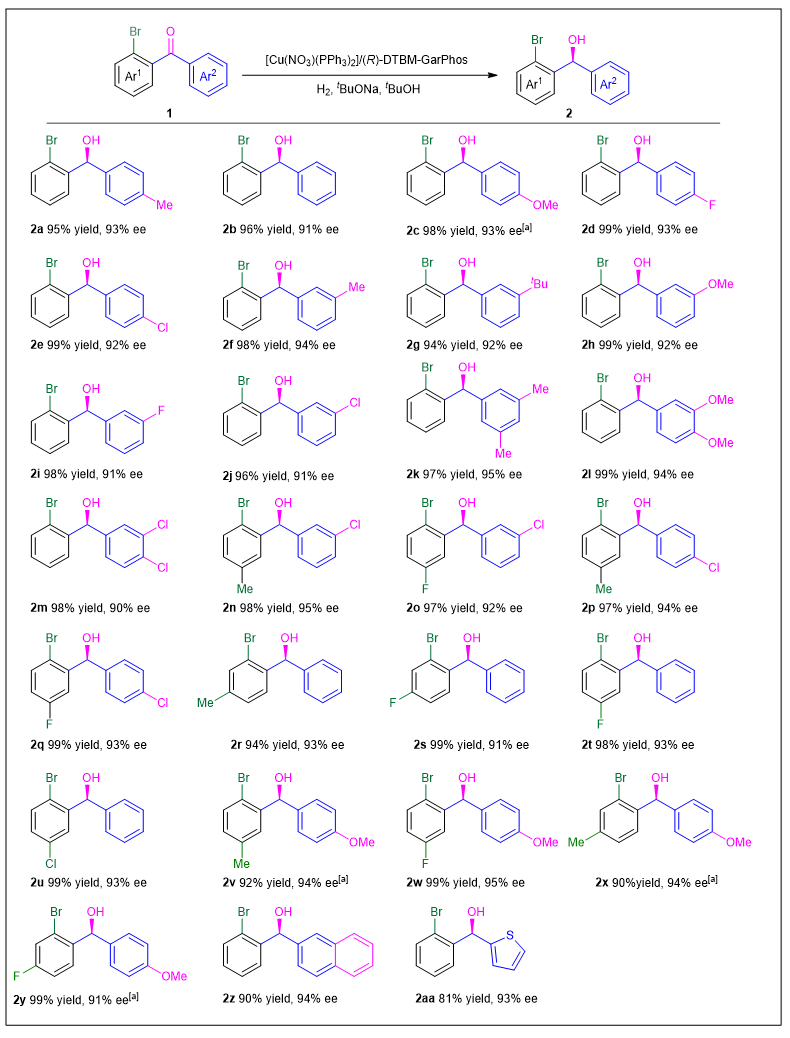
Figure 3. a ) Kinetic experiments of substrates with ortho -substituted halogen groups. b ) Relationship of ee values of the products and ortho -substituted groups. 为了验证底物的适用性,作者对一系列非对称邻位溴取代的二芳基酮进行了相应的催化氢化反应。所有产物均以优异的对映选择性(91-95% ee)和高达99%的产率获得(Scheme 1)。
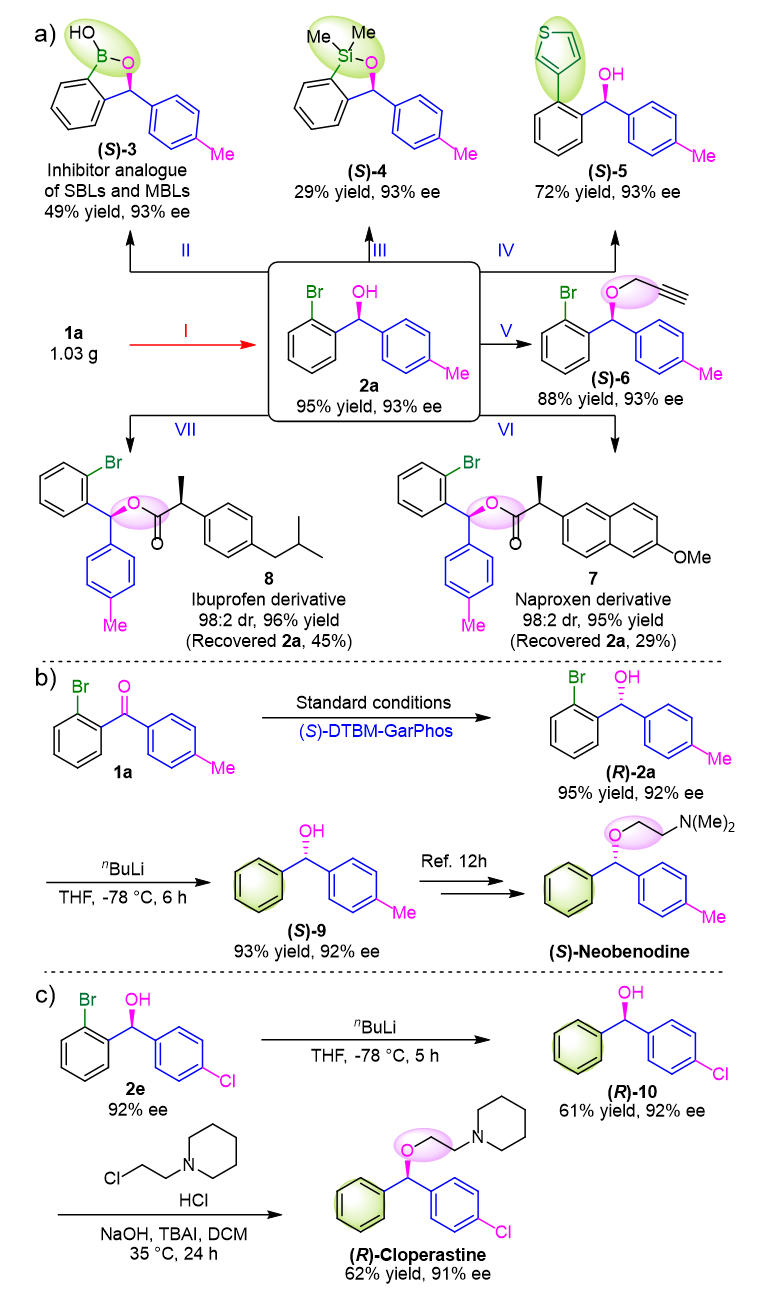
Scheme 1. Substrate scope of o -Br substituted benzophenones 1 . 为了进一步检验铜催化体系的实用性,作者进行了系列官能团转化以及合成了(S )-Neobenodine的关键中间体和商业化药物(R )-Cloperastine(Scheme 2)。
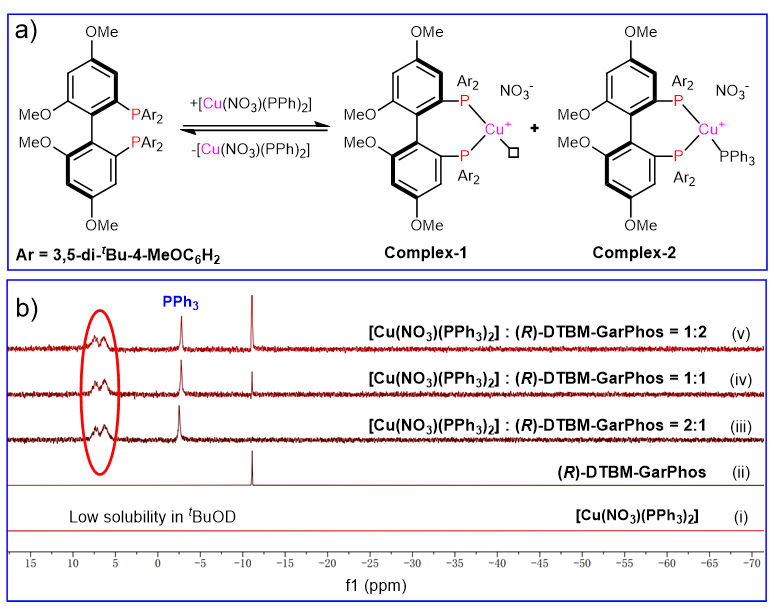
Scheme 2. Gram-scale preparation and further transformations of chiral benzhydrols. 为了探索氢化反应的机理,作者使用1a 作为底物,在D 2 t B uOD条件下分别进行了氘标记实验。结果表明,手性碳上的氢原子来源于H 2 31 P NMR研究了[Cu(NO 3 )(PPh 3 ) 2 ] 与(R )-DTBM-GarPhos在不同比例下的配位实验(Figure 4a, b)。由于[Cu(NO 3 )(PPh 3 ) 2 ] 在高粘度的t B uOD溶剂中溶解度低,在31 P NMR谱图中未观察到其信号(Figure 4i)。在2/1、1/1和1/2 M/L的比例下观察到相同的新信号峰(Figure 4ii-v)。HRMS实验(M/L = 2/1、1/1和1/2)表明配位体系可能只存在Complex-1 和Complex-2 的络合物。通过非线性效应实验研究,得到完全的线性关系结果。这些实验结果表明,活性催化剂物种是一个金属/配体为1:1的配位络合物。
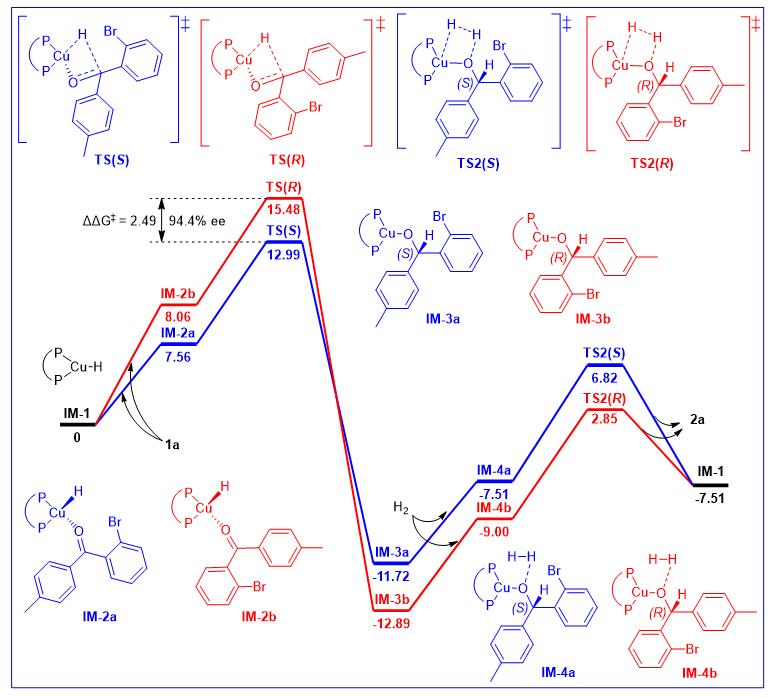
Figure 4. Coordination experiments of [Cu(NO 3 )(PPh 3 ) 2 ] with (R )-DTBM-GarPhos in t B uOD. 接下来,为了进一步探究反应中立体选择性的起源机制,作者进行了密度泛函理论(DFT)计算(Figure-5)。Cu(I)-H 物种IM-1 首先与底物1a 配位,形成两个中间体IM-2a 和IM-2b ,其能量分别为7.56和8.06 kcal/mol。这种吸热的配位能量可以归因于配体空间位阻较大。然后,Cu(I)-H 发生迁移插入到羰基中,通过过渡态TS(S ) (12.99 kcal/mol)和TS(R ) (15.48 kcal/mol),分别生成中间体IM-3a 和IM-3b 。这一步是立体化学的决定步骤。ΔΔG ‡ S H 2 IM-4a 和IM-4b 。最后,在通过TS2(S ) 和TS2(R ) 异裂H 2 2a ,并伴随着Cu-H 物种的释放。
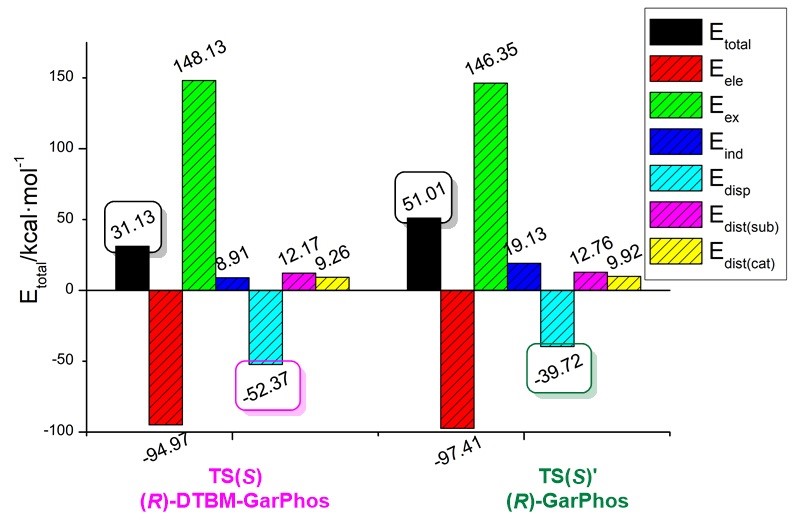
Figure 5. Proposed stereochemical model for the Cu-catalyzed asymmetric hydrogenation of 1a . 作者还利用IGMH对TS(R ) 和TS(S ) 中底物与Cu-H 催化剂之间的弱相互作用进行了可视化分析。值得注意的是,配体的叔丁基基团通过与底物的CH···HC吸引色散相互作用稳定了过渡态(在TS(S ) 和TS(R ) 中分别为-52.37和-53.29 kcal/mol)。但是,ΔE disp E ind E ex E ind E ex TS(S ) 和TS(R ) 之间的能量差异,表明空间位阻和诱导相互作用对对映选择性贡献最大。在所有能量共同作用下导致TS(S ) 的E total TS(R ) ,与实验结果相匹配。此外,作者还使用(R )-GarPhos为配体进行了相应TS(S )' 计算。如Figure 7所示,TS(S ) 的总能量显著低于TS(S )' (31.13 vs 51.01 kcal/mol),并且TS(S ) 中的色散相互作用明显强于TS(S )' (-52.37 vs -39.72 kcal/mol)。这些计算结果与实验结果一致(Table 1,entry 6和9)。
Figure 6. Independent gradient model based on Hirshfeld partition (IGMH), CH…HC attractive interactions, and energy decomposition analysis (EDA).
Figure 7. Energy decomposition analysis (EDA) of TS(S ) and TS(S )' . 本文开发了一种丰产金属铜催化的邻位溴取代二芳基酮的不对称氢化反应,制备一系列具有优异产率和对映选择性的手性二芳基醇(高达99%收率,高达95%对映选择性)。Fukui函数(f + S )-Neobenodine的关键中间体和商业化药物(R )-Cloperastine。机理实验揭示了不对称氢化的过程和催化剂的配位模式。DFT计算以及IGMH和EDA分析表明,催化剂和底物之间的CH···HC多重色散相互作用起着关键作用,降低了反应能量,提高了催化剂活性。 上述研究成果近期发表在Angew. Chem. Int. Ed. 管静 为第一作者,上海交通大学张万斌 教授、陈建中 副研究员为该论文的通讯作者。 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文 ):
Copper-Catalyzed Asymmetric Hydrogenation of Unsymmetrical ortho -Br Substituted Benzophenones
Jing Guan, Yicong Luo, Qiyuan Wang, Jianzhong Chen*, and Wanbin Zhang* Angew. Chem. Int. Ed . 2024 , DOI: 10.1002/anie.202416313
张万斌,上海交通大学化学化工学院讲席教授;1997年在日本大阪大学取得博士学位;1997年至2001年在日本大阪大学工学部应用化学系任助理教授;2001年至2003年在日本三菱化学株式会社横滨综合研究所任主任研究员;2003年至今上海交通大学教授/特聘教授/讲席教授;2017年起担任上海市手性药物分子工程重点实验室主任。 张万斌教授长期从事不对称催化和药物及其关键中间体的高效合成方法研究。主持和参加国家重大新药创制专项、国家自然科学基金委重大、重点及面上项目以及上海市科委、教委和经信委重大和重点科研项目等。在催化剂的创制、反应的设计以及工艺的开发等研究领域取得了系统性研究成果。相关研究成果已发表包括Science , Nat. Chem., Nat. Sci., J. Am. Chem. Soc., Angew. Chem. Int. Ed. 和Nat. Commun. 在内的SCI论文360余篇,获得授权发明专利50余项。已有多项科研成果实现工业化应用或技术转让,实现了薄荷醇、贝达喹啉、布瓦西坦、瑞德西韦和青蒿素等多种重要手性化合物产业化的关键技术突破,其中柠檬醛的高效不对称氢化转化技术已被成功应用于年产1000吨薄荷醇工业化生产;自主设计开发的双环咪唑催化剂在磷手性控制方面(比如核苷前药和农药)表现出独特的性能,成功用于抗病毒药物瑞德西韦的首次不对称催化合成。入选国家“万人计划”教学名师、中国化学会会士,上海领军人才和上海市优秀学术带头人。曾获上海市自然科学奖一等奖、中国产学研合作创新成果奖一等奖和上海市产学研合作优秀项目奖特等奖等多项奖励。