清华大学刘磊团队ACS Cent. Sci. | 人类蛋白型态组的化学合成及生物医学应用
英文原题:Chemical Synthesis of Human Proteoforms and Application in Biomedicine

通讯作者:刘磊 (Lei Liu)
作者: 艾华松 (Huasong Ai)、潘漫 (Man Pan)、刘磊 (Lei Liu)
背景介绍
破译分子水平的人类遗传密码是生物医学研究的一项基本任务。尽管 “人类基因组计划 ”已成功破译了核酸所携带的信息,但我们对蛋白质这一生命活动的直接执行者和连接基因型与表型的核心中介分子的了解仍然有限,其主要原因是蛋白质结构和功能的复杂性远远超出了遗传密码所决定的线性氨基酸序列。在后基因组时代,人们对带有复杂翻译后修饰的人类蛋白型态的功能及其分子机制了解仍然不足,已成为人类健康和疾病研究的重大障碍。使用重组表达等传统生物学技术难以对各种蛋白型态进行深度解析,而蛋白质化学合成可在原子精准的尺度制备各种结构明确的人类蛋白型态,为解答上述问题提供了实践可行的途径。在本文中,我们介绍人类蛋白质型态研究中使用化学方法合成蛋白质的机遇和挑战,期待通过蛋白质化学合成的不断创新与实践,更加凸显合成化学对于生物医学研究的重要价值。
文章亮点
本文提出的“人类蛋白型态组化学合成”这一科学任务,包括:1) 发展易于使用的多肽连接化学方法,更加高效地从头合成任意蛋白结构域;2) 发展稳健的临时结构支撑策略,为更具挑战性的蛋白质连接方法和折叠复性提供途径;3) 发展高效的蛋白质结构域-结构域转肽连接方法,实现复杂多结构域蛋白质的高效合成。上述任务的实现,将为人类蛋白型态互作网络的全面分析与鉴定、蛋白型态复合物功能机制的精准阐明和解析、以及蛋白型态靶向药物的开发与优化等生物医学研究搭建重要的方法基础(图1)。
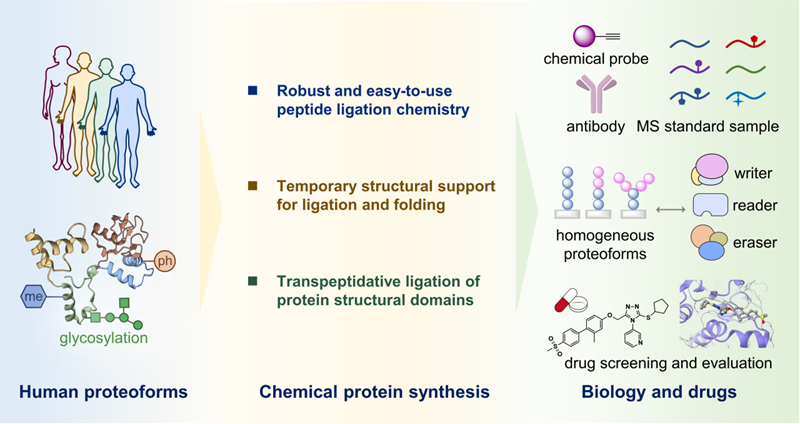
图1. 人类蛋白型态化学合成与生物医学应用示意图
图文解读
在相同的基因模板上,DNA 基因变异、RNA选择性剪接和蛋白质翻译后修饰(PTM)等各种因素可导致产生结构及功能不同的蛋白质,即蛋白质型态,它们是生物功能的最终分子效应器,给通过基因型来推断表型的经典理论体系带来了新挑战。有估计表明,人类蛋白质编码基因(约 20,000 个)映射到超过107 种独特的蛋白型态,其中许多型态与人类多种疾病密切相关。过去20年的医学数据表明,基因组和转录组的变异只能充分解释不到 10%的临床疾病,因而有必要针对基于蛋白质的诊断和治疗策略中忽略的众多关键靶点进行更加深入的研究。揭示蛋白型态的多样性和功能对于基础研究和转化研究都至关重要,尤其是剖析和分析各种蛋白型态的分布和相互作用、系统定量重建各种蛋白型态的生化事件、以及在原子分辨率准确阐明各种蛋白型态的分子机制。然而,传统的生物学方法在研究人类蛋白型态时遇到了瓶颈,主要原因是难以获取结构精确、携带明确翻译后修饰的蛋白型态来支持研究。蛋白质化学合成是一种有效的从氨基酸单元构建蛋白质的方法,可以在原子精度上制备各种结构的蛋白质型态,为精准鉴定及高通量定量分析各种复杂蛋白质型态、阐明各种蛋白质型态的功能机制并发展靶向干预策略等提供关键方法,有望从科学源头上拓展人类蛋白质型态研究的范畴和能力(图 2)。
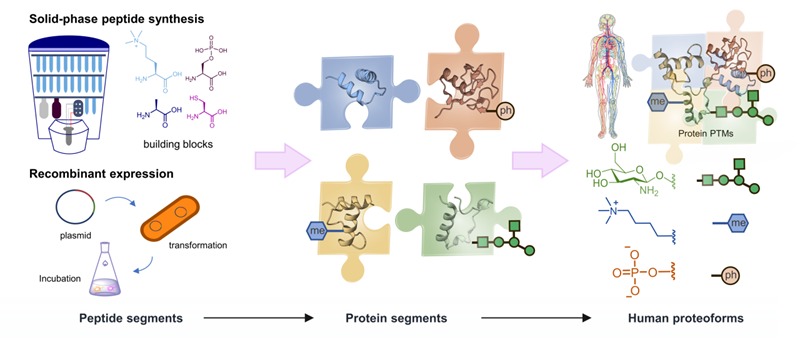
图2. 人类蛋白质型态的化学蛋白质合成概念图。通过固相多肽合成和重组表达获得的蛋白质片段被组装成蛋白质结构域,然后通过结构域连接获得人类蛋白质型态。
蛋白质化学合成历经Fischer等早期探索(20世纪上半叶)、结晶牛胰岛素合成(20世纪50-60年代)、固相多肽合成(20世纪60-80年代)、生物正交化学(20世纪90年代-21世纪初)等阶段,一直局限于寻找蛋白亲电试剂与亲核试剂的反应,长期困扰于蛋白亲电试剂高能酰基稳定性差、依赖复杂保护基等难题。刘磊团队在2011年发现了蛋白酰肼连接反应(Angew. Chem. Int. Ed. 2011, 50, 7645),实现了只依赖蛋白亲核试剂的人工蛋白合成,从原理上摆脱了蛋白质肽键生成必须依赖传统亲电-亲核二元反应途径的思想束缚,突破了历史上蛋白质需要规避氧化剂的思维误区,开辟了“氧化”合成蛋白质的新途径。蛋白酰肼法已被国际学术界与工业界普遍采用,可在百毫克量级结晶纯度制备任意结构并可达500氨基酸的蛋白质,理论上已覆盖人类蛋白质型态组的61%。
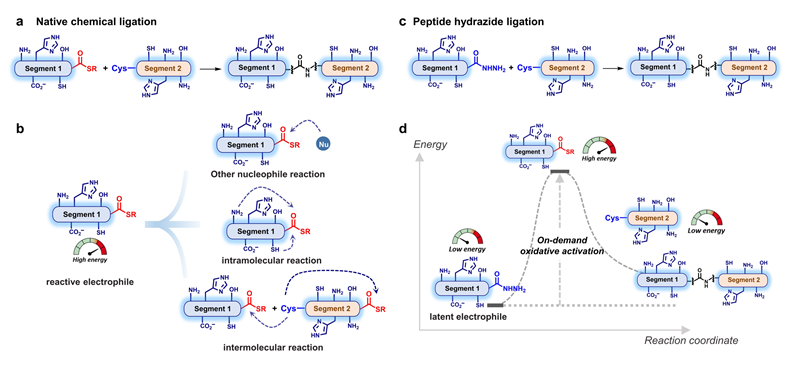
图3. 自然化学连接与蛋白酰肼连接的化学反应性分析。(a) 自然化学连接策略。(b) 高能亲电试剂的缺点包括其它亲核反应、分子内反应或分子间反应引起的不稳定性。(c) 酰肼连接法,低能蛋白酰肼与含 Cys 的蛋白连接反应。(d) 蛋白酰肼连接中间产物的能量图解。低能酰肼(亲电体)按需氧化活化,得到高能肽硫酯,然后与低能含 Cys 蛋白连接,得到组装蛋白。
总结与展望
未来蛋白质化学合成需要进一步发展蛋白质化学合成的新反应、新策略,并与信息、工程、材料等学科进一步交叉融合,需要发展基于流式化学反应的新一代智能化蛋白质合成仪器,以攻克超快蛋白合成、膜蛋白合成、超大蛋白拼接、可控蛋白折叠、AI自动化合成等系列难题,实现蛋白质化学合成技术的系统性升级与突破,跨越1000氨基酸、2000氨基酸等蛋白质合成里程碑,最终发展建立可覆盖人类蛋白质型态组的精准、高效、程序化蛋白质化学合成方法系统。上述方法系统的建立,将极大提升人类在化学精度上操纵蛋白质分子的能力,成为蛋白质型态的深度解析和生物医学应用的核心方法基础,促进各种命运抉择过程关键蛋白质型态的在体分析、功能探索、机制阐明等,促进重大复杂疾病中靶向关键蛋白质型态的药物设计和诊疗新方法开发,开拓“化学精度”研究人类健康与疾病的新范式,推动蛋白质型态的生物医学基础研究及发展精准医学诊疗新方法与新药物。
通讯作者信息
刘磊 教授
清华大学化学系教授、系主任、生命有机磷化学及化学生物学教育部重点实验室主任,新基石研究员、拜耳讲席教授。主要从事蛋白质化学合成研究,通过发现新的化学反应和合成策略,发展稳健高效的方法系统,突破生物学的限制,实现任意结构蛋白质的人工化学合成,并结合在体功能分析、生物化学机制、及化学分子调控等多学科方法,从独特的技术路径来推动生命健康的深入研究,促进精准医学诊疗技术的研发。
扫描二维码免费下载全文,或点此查看原文

ACS Cent. Sci. 2024, ASAP
Publication Date: July 22, 2024
https://doi.org/10.1021/acscentsci.4c00642
Copyright © 2024 The Authors. Published by American Chemical Society


Editor-in-Chief
Carolyn R. Bertozzi
Stanford University

Deputy Editor
Kirk S. Schanze
University of Texas at San Antonio College of Sciences
ACS Central Science 出版有关化学及其相关领域最引人注目的研究成果,其中化学方法起到关键作用。同时, ACS Central Science是美国化学会出版的第一本完全开放获取期刊,旨在探讨化学基础领域的重要进展,以及应用和跨学科研究,重点介绍化学在其他众多科学学科中的重要作用。
2-Year Impact Factor
CiteScore
Time to First Peer Review Decision
12.7
25.5
41.6


如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号