贻贝又上Science:“粘得牢+逃得快”的小秘密
贻贝不仅是不少人喜爱的鲜美食材,还是很多化学家的灵感源泉,贻贝的身影也屡屡登上顶级期刊。受贻贝的启发,化学家设计合成了多种仿生材料,通过操纵分子尺度的相互作用,在可持续型强力粘合剂(Nature, 2023, 621, 306, 点击阅读详细)、可抑制贻贝附着的亲空气表面(Nat. Mater., 2023, DOI: 10.1038/s41563-023-01670-6, 点击阅读详细)、超强韧弹性体(Science, 2017, 358, 502, 点击阅读详细)等方向取得了丰硕成果。

图片来源:Matter[1]
有趣的是,贻贝不仅能靠着足丝(Byssus)和粘附蛋白牢牢地抓住岩礁,当遇到恶劣环境时,它们还能够迅速地丢弃足丝,从岩石上快速脱落,重新获得活动能力并逃离不利环境,寻找新的栖息地。它们的足丝可以在几小时内重新生长出来,并重新粘附在新的岩石上。强大的粘附力与快速可逆的脱落似乎是矛盾的,那么,贻贝的足丝是如何做到粘附与脱落相统一的呢?
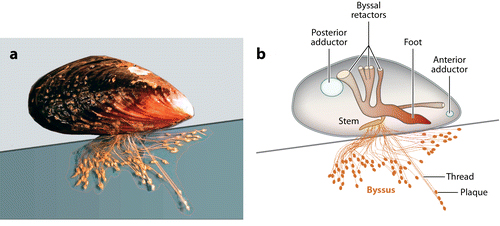
贻贝及足丝结构示意图。图片来源:Annu. Rev. Mater. Res. [2]
近日,加拿大麦吉尔大学Matthew J. Harrington课题组在Science 杂志上发表论文,揭示了贻贝的快速脱落机理。研究发现,这种能力源于纤毛的振荡运动以及足丝根部和贻贝足组织之间机械相互作用的变化,而这些又受到神经递质的调控。这种动态的生物界面为非生命材料与活组织之间的动态连接提供了有益的参考。
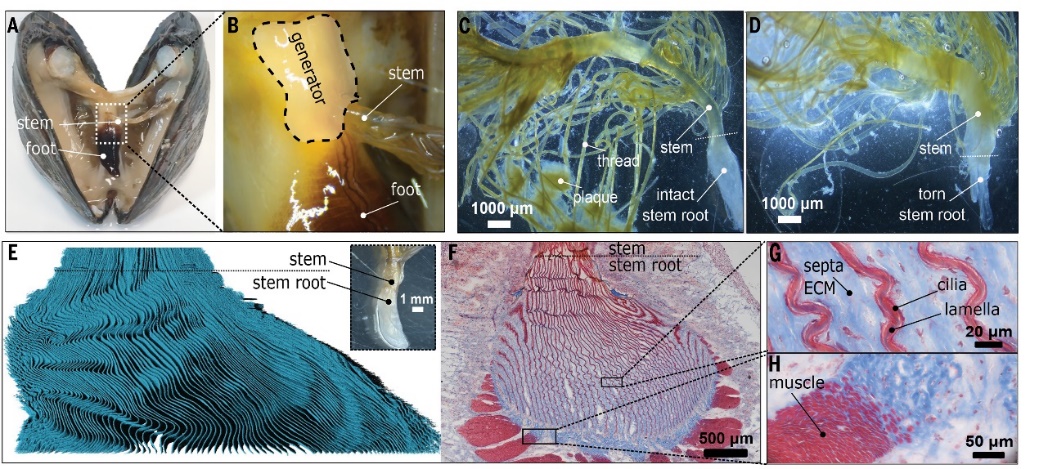
贻贝足丝的微观分层结构。图片来源:Science
使用拉伸实验机强行扯下贻贝的足丝,需要6.4±1.6 N的力,且根部末端显示出折断和撕裂的状态。然而,当贻贝需要释放足丝时,却可以轻松剥离,力量之小以至于难以测量,根部也呈现出平滑而锥形的外观。这表明,足丝根部一定存在某种调节机制,可以在需要时保持坚固,又能快速释放。

通过计算机显微断层扫描(PCE-μCT)、Masson's三色染色法分析以及聚焦离子束-扫描电子显微镜(FIB-SEM)对足丝进行成像,可以发现其根部由40多个单独的片层组成,每个片层的厚度为2到3 μm,呈波浪状。这些片层之间的软组织中覆盖着无数的纤毛,大大增加了界面接触的相互作用力。
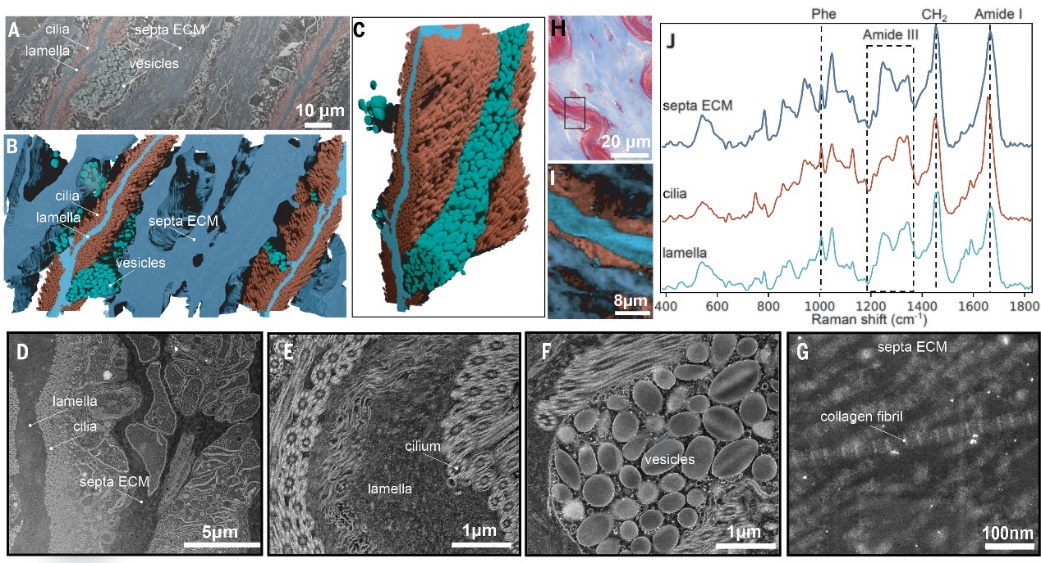
足丝根部生物界面的结构分析。图片来源:Science
随后,研究者揭示了足丝轻松释放的机理。通过给贻贝注射血清素或多巴胺,成功改变了足丝脱落的力的大小。当注射200 μM的血清素后,纤毛的运动被激活,粘附力减小,足丝轻松被拉出;相比之下,当注射70 μM多巴胺后,拉出的作用力反而会增加到20.1±5.9 N。

神经递质调控纤毛运动,使足丝快速脱落。图片来源:Science
据估计,大约有57亿根纤毛与足丝根部接触,如果施加的力分布均匀,每根纤毛将承受约3.5 nN的作用力。这种设计并非独一无二,类似的机制在生物界中也有所见,比如,壁虎的趾垫上也排列着数十亿个微小的“吸盘”,每个“吸盘”能承受2~16 nN的摩擦力,足以支撑壁虎在墙上爬行。在不同的剥离角度下,粘附力可以相差几个数量级,从而实现粘附与快速脱落的可逆性。
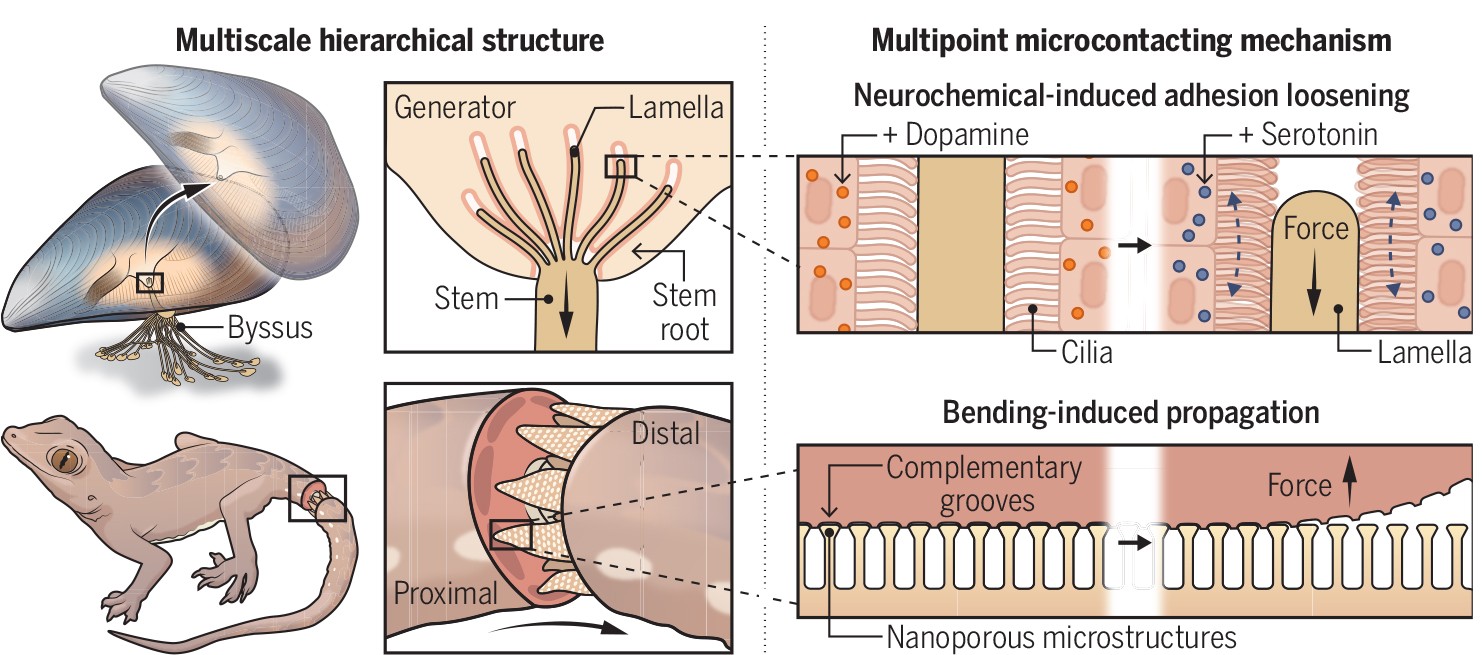
自然系统中的动态生物界面。图片来源:Science
再比如,蜥蜴在受到威胁时,往往采取断尾求生的策略,其尾部也存在类似的由肌肉束组成的“插座”结构,可以在神经递质的诱导下自行断开。龙虾和螃蟹受伤后,爪子也会发生自然脱落,其中是否存在着类似的机制也未可知。或许这种可逆的动态生物界面也可以借鉴到人机系统、植入医疗器械等领域的设计和研发中。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A strong quick-release biointerface in mussels mediated by serotonergic cilia-based adhesion
Jenaes Sivasundarampillai, Lucia Youssef, Tobias Priemel, Sydney Mikulin, E. Deniz Eren, Paul Zaslansky, Franziska Jehle, Matthew J. Harrington
Science, 2023, 382, 829-834. DOI: 10.1126/science.adi7401
参考文献:
[1] Z. Wang, et al., Mussel-Inspired Surface Engineering for Water-Remediation Materials. Matter 2019, 1, 115-155. DOI: 10.1016/j.matt.2019.05.002
[2] B. P. Lee, et al. Mussel-Inspired Adhesives and Coatings. Annu. Rev. Mater. Res. 2011, 41, 99-132. DOI: 10.1146/annurev-matsci-062910-100429
[3] G. Pan & B. Li, A dynamic biointerface controls mussel adhesion. Science 2023, 382, 763-764. DOI: 10.1126/science.adl2002
(本文由小希供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号