Science:天然产物调控肠道菌群的新机制
人体内有数以万亿计的微生物,它们对调节宿主功能具有深远影响。这些微生物存在于胃肠道中,并且已被证实能够影响身体不同系统的正常生理活动。肠道及其他部位微妙的微生物稳态的打破与许多疾病有关,包括代谢性疾病、神经系统疾病、心血管疾病、胃肠道疾病,甚至癌症。然而,粪菌移植等靶向整体肠道菌群的干预措施仍具有成分复杂、可控性差等局限,肠道菌群调控代谢性疾病的关键介质与作用机制亟待深入解析,以发现特异性靶点与干预措施。肠道共生菌的各种酶在代谢产物的生成及代谢过程中发挥重要作用。此外,肠道菌源酶还具有多种非代谢产物依赖的功能,但它们在宿主代谢性疾病中的作用尚不清晰。
糖尿病是世界范围内最主要的代谢性疾病之一。目前,中国是全球糖尿病第一大国,2019年我国二型糖尿病患病人数为1.274亿人,在人口老龄化和快速城市化带来不良的生活方式下,我国糖尿病人口数量还将明显增加。肠道微生物作为连接人体内外环境的桥梁,已被证明在多种人类代谢性疾病发生发展中发挥重要作用。
天然产物是疾病传统治疗的重要方式,其成分常作为先导分子广泛用于抗生素和抗癌药物的开发。随着源于筛选库的药物发现遇到瓶颈,人们开始更多关注天然产物来源的活性物质及其在混合物中的独立药理效应。目前,多种各国传统药和其分离的天然产物已被证实可用于治疗阿尔茨海默病、糖尿病以及妇科和神经性疾病。基于天然产物的生物探索为药物发现提供了多样性,有望缓解当前药物发现来源方面的不足。然而,这项艰巨的任务需要我们重新认识天然产物在生物体内发挥调控功能的机制,尤其是被忽视的非典型作用机制。
北京大学医学部基础医学院/北京大学第三医院医学创新研究院姜长涛教授团队、北京大学第三医院/北大-清华生命科学联合中心乔杰教授团队、北京大学化学与分子工程学院/北大-清华生命科学联合中心雷晓光教授团队、美国国立卫生研究院Frank Gonzalez教授团队、以及首都医科大学朝阳医院王广教授团队合作,于近日在Science 杂志在线发表了研究论文,首次提出了“肠道菌源宿主同工酶(Microbial-host-isozyme,MHI)”新概念,发现菌源宿主同工酶在肠道中的广泛存在,可以模拟宿主酶的功能,并参与疾病的发生发展。其中,菌源DPP4是一种重要的同工酶,可以在肠屏障损伤条件下进入肠组织,降解宿主活性GLP-1,诱导糖耐量异常。宿主DPP4抑制剂西格列汀无法有效抑制菌源DPP4活性,是西格列汀临床治疗响应性个体差异大的重要原因。进一步,通过高通量药物筛选以及深入的功能验证,研究团队发现了首个对菌源DPP4具有高活性和强选择性的四氢异喹啉生物碱类天然产物小分子抑制剂Daurisoline,可以通过特异性抑制菌源DPP4,改善糖耐量异常,从而对二型糖尿病具有潜在的治疗效果。
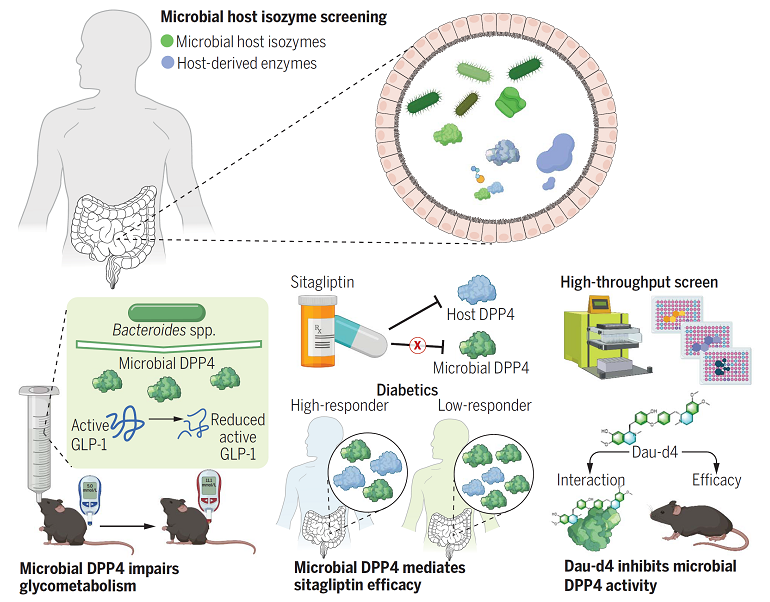
图1. 工作摘要图
在评估菌源宿主同工酶活性的过程中,研究人员发现宿主二肽基肽酶4(DPP4)的菌源同工酶活性在不同个体中表现出了最强的稳定性和普遍性。DPP4是一种丝氨酸水解酶,宿主DPP4可以通过水解并失活胰高血糖素样肽-1(GLP-1)等胃肠道多肽类激素,发挥调控胰岛素分泌等多种生理功能,是2型糖尿病及其相关代谢紊乱的重要干预靶点。然而,GLP-1主要由肠组织释放进入循环,而肠道菌群产生的蛋白类物质主要聚集于肠腔,那么,菌源DPP4是否可以接触宿主GLP-1,发挥宿主DPP4类似的病生理功能?研究人员发现在长期高脂饮食处理、低浓度葡聚糖硫酸钠(DSS)、吲哚美辛等诱导的肠屏障受损条件下,菌源DPP4可以进入肠组织,显著降低活性GLP-1水平、诱导糖耐量异常。肠屏障损伤是包括2型糖尿病在内的多种代谢性疾病的共同病理特征,因此,菌源DPP4可以在肠屏障受损的条件下,进入宿主体内,跨物种诱导糖耐量异常。通过肠道共生菌株的分离培养、DPP4活性检测、基于CRISPR-Cas系统的厌氧菌基因敲除体系以及多种动物模型,研究人员发现了多形拟杆菌、普通拟杆菌等多种拟杆菌属细菌均具有菌源DPP4活性,并鉴定了菌源DPP4的编码基因。多形拟杆菌可以以菌源DPP4依赖的方式降低宿主活性GLP-1水平,诱导高脂饮食小鼠糖耐量异常。以上发现揭示了肠道菌群影响代谢性疾病的全新病理基础与作用机制。
DPP4抑制剂西格列汀在临床上广泛用于2型糖尿病的治疗,是2021年全球销量第二的抗糖尿病小分子药物。然而,西格列汀的治疗效果具有较大的个体差异,临床研究发现,西格列汀对约40%的患者无法发挥有效降糖作用,其机理尚未阐明。菌源DPP4是否有可能在其中发挥了一定作用?利用酶活抑制实验及西格列汀与菌源DPP4的共结晶分析,研究人员发现目前西格列汀等针对人DPP4开发的治疗药物对菌源DPP4的抑制作用较弱。研究人员进一步招募了57名初诊2型糖尿病患者进行了为期3个月的西格列汀干预研究,与此前报道一致,不同患者对西格列汀干预的疗效具有较大的个体差异。基于多组学关联分析、菌群移植、噬菌体靶向干预实验,研究人员发现多形拟杆菌产生的btDPP4介导了西格列汀的临床响应性,为西格列汀临床响应性个体差异的提供了分子机理与作用靶点。
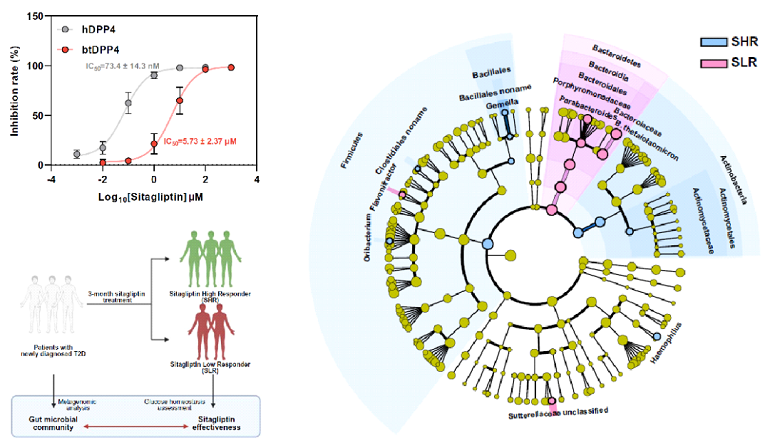
上述结果提示菌源DPP4是2型糖尿病的新型菌源治疗靶点。因此,研究人员建立了靶向菌源DPP4的高通量药物筛选体系,通过对约11万个小分子化合物的高通量药物筛选,发现了传统中药北豆根中活性成分天然产物蝙蝠葛苏林碱daurisoline (Dau) 具有最强的菌源DPP4抑制活性,而对宿主DPP4没有抑制作用。经过进一步的化合物结构改造与活性评价,研究人员确定了蝙蝠葛苏林碱的衍生物Dau-d4是一种强效高选择性的菌源DPP4抑制剂,并且通过晶体结构解析揭示了Dau-d4特异性地抑制菌源DPP4而对宿主DPP4无抑制作用的结构基础。Dau-d4可以通过抑制菌群DPP4来改善糖耐量,同时,Dau-d4对肠道共生菌的生长与组成则没有明显影响,这些结果表明,Dau-d4可以在不干扰菌群整体功能的条件下,特异性靶向菌源DPP4,有效改善小鼠糖代谢紊乱。

肠道菌群调控代谢性疾病的分子机制与靶向干预研究不仅是代谢性疾病研究的重要方向,同时也是肠道菌群领域进入精准化、靶向性研究阶段的关键环节,本工作提出了“肠道菌源宿主同工酶”全新概念,以此为基础探索了菌源宿主同工酶在代谢性疾病的发病及治疗过程中的重要作用,并构建了“靶点发现—机制验证—药物筛选—疗效验证”的全链条研究体系,为后续基础研究与临床治疗提供了新的研究思路与方向。解析肠道菌源酶的功能和在代谢性疾病中的作用,有望实现特异性调控菌株功能且不影响菌群组成,从而为靶向肠道菌群的代谢性疾病精准化治疗带来新的突破。该工作也进一步说明开展基于天然产物的化学生物学与创新药物研究对于深入理解人类重大疾病的机制和开发创新药物具有重要意义。
姜长涛教授、乔杰教授、雷晓光教授、Frank Gonzalez教授与王广教授为本文的共同通讯作者。北京大学医学部基础医学院博士后汪锴、北京大学医学部基础医学院博士生张志威、北京大学第三医院杭婧副研究员、首都医科大学朝阳医院刘佳教授以及北京大学化学学院博士后郭富生为本文的共同第一作者。该工作得到国家自然科学基金,国家科技部重点研究发展计划,北京市“卓越青年科学家计划”,北京分子科学国家研究中心、北大-清华生命科学联合中心等多个国家重大科研项目和研究机构的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Microbial-host-isozyme analyses reveal microbial DPP4 as a potential antidiabetic target
Kai Wang†, Zhiwei Zhang†, Jing Hang†, Jia Liu†, Fusheng Guo†, Yong Ding, Meng Li, Qixing Nie, Jun Lin, Yingying Zhuo, Lulu Sun, Xi Luo, Qihang Zhong, Chuan Ye, Chuyu Yun, Yi Zhang, Jue Wang, Rui Bao, Yanli Pang, Guang Wang*, Frank J. Gonzalez*, Xiaoguang Lei*, Jie Qiao*, Changtao Jiang*
Science, 2023, DOI: 10.1126/science.add5787
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号