清华大学唐叶峰教授课题组近年来研究工作概览
唐叶峰教授简介
1999年本科毕业于兰州大学化学院基地班,其后在中国医学科学院药物研究所师从陈世智教授获得药物化学硕士学位。2006年,于北京大学化学院获得有机化学博士学位(导师为杨震教授和陈家华教授),随后加入美国The Scripps Research Institute的K. C. Nicolaou教授课题组从事博士后研究(2006-2009年)。2010年加入清华大学,现为药学院教授、博士生导师。曾获得国家自然科学二等奖(2016,第三完成人)、广东省科学技术奖励一等奖(2015,第四完成人)、中国药学会科学技术奖一等奖(2019,第七完成人)、清华大学-拜尔研究员、清华大学-杨森研究员、Thieme Chemistry Journals Award、清华大学优秀博士论文指导教师(2018,2021)等荣誉和奖励。

课题组主要研究兴趣为天然产物导向的合成化学、药物化学和化学生物学研究,即以具有重要生物功能的天然产物为研究对象,通过发展新策略、新反应和新技术,实现目标分子的快速、高效和多样性合成;在此基础上,将获得的活性分子应用于药物化学和化学生物学研究,为发现新药物、新靶点和新机制提供物质基础和理论支持。迄今为止,在本领域重要期刊(如Acc. Chem. Res., J. Am. Soc. Chem., Angew. Chem. Int. Ed., Cell. Res., Chem. Sci., Green Chem., Org. Lett.等)上发表SCI论文80余篇,获得专利5项(PCT专利2项),参与编写专业教材1部。
下面,简要介绍唐叶峰课题组近年来在天然产物导向的合成化学、化学生物学和药物化学等研究领域取得的代表性研究成果。
(一)复杂活性天然产物全合成
天然产物全合成是通过化学手段构筑天然分子的一门学科,也是化学家认识自然和改造自然的实践过程。作为合成化学领域最具挑战性的研究方向之一,天然产物全合成在提升国家综合化学实力、促进创新药物研发和培养尖端化学人才方面发挥着不可替代的重要作用。长期以来,唐叶峰教授课题组聚焦于具有重大合成挑战性和重要生物活性的天然产物及药物分子,通过“仿生策略和特色合成方法学相结合”的研究模式,系统解决了多个家族、超过70个天然分子的高效及多样性合成问题,并发现了一些具有应用转化前景的药物先导物和探针分子,为创新药物研究提供了坚实的物质基础和理论支撑(图1)。
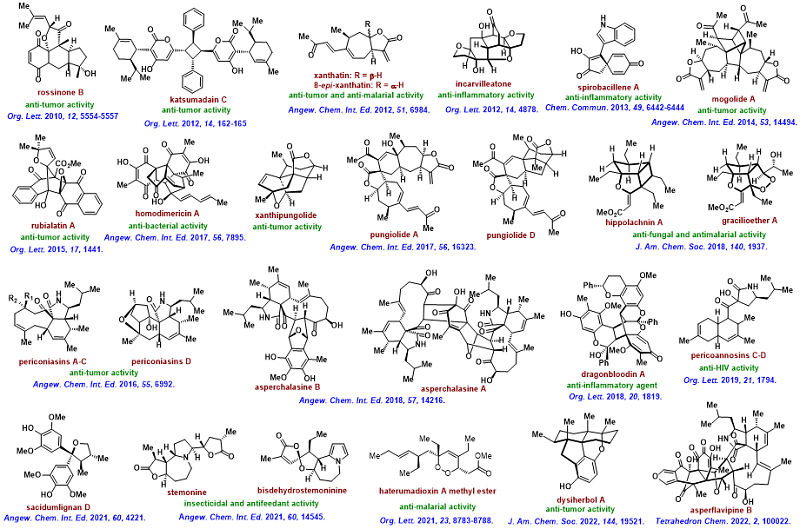
图1. 唐叶峰课题组完成的代表性天然产物
2021年,唐叶峰教授应邀在Acc. Chem. Res.上发表综述,系统总结了该课题组在天然产物全合成领域取得研究成果(Acc. Chem. Res., 2021, 54, 3720–3733)。以下,选取该课题组完成的一些代表性天然产物全合成工作进行介绍:
1)发展新型dyotropic重排反应,实现苍耳烷倍半萜和百部生物碱的高效、集群式合成
β-环丙内酯dyotropic重排反应是一类独特的化学转化。在路易斯酸条件下,β-环丙内酯C-O键和相邻C-X(X = H, C或O)键可发生1,2-迁移交换反应,生成扩环产物γ-丁内酯。历史上,关于该类反应的研究非常欠缺,造成反应类型单一、反应机理模糊以及反应结果难以预测,大大限制了该类反应的合成应用价值。近年来,唐叶峰课题组围绕该类反应展开了系统深入的研究,在拓展反应类型、阐明反应机理、总结反应规律和推广合成应用价值方面取得了一系列具有创新性和系统性的研究成果,其中代表性工作包括:1)发展了多种新型β-环丙内酯及β-内酰胺dyotropic重排反应(Angew. Chem. Int. Ed. 2012, 51, 6984; Angew. Chem. Int. Ed. 2021, 60, 4221)(图2A),通过调控不同类型底物的立体和电子效应,实现重排过程的化学选择性和立体专一性,从而大大扩展了其反应类型和应用场景;2)运用计算化学手段,对反应中各类基团的迁移规律进行了系统研究,对影响反应结果的不同因素进行了归纳和总结(Org. Chem. Front. 2022, 9, 329.)(图2B),为预测反应结果以及设计、开发新反应提供了理论依据;3)以上述dyotropic重排反应为关键步骤,实现了苍耳烷倍半萜和百部生物碱的高效、集群式合成(Angew. Chem. Int. Ed. 2014, 53, 14494; Angew. Chem. Int. Ed. 2017, 56, 16323; Angew. Chem. Int. Ed. 2021, 60, 14545)(图2C),充分展示了此类反应在复杂天然产物合成方面的应用价值。
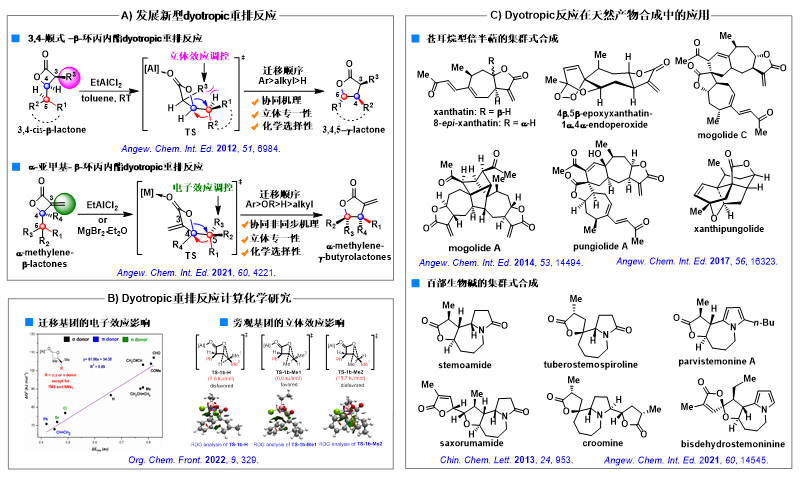
图2. Dyotropic重排反应研究及其在复杂天然产物全合成中的应用
2)发展新颖独特的环张力驱动的构环反应,实现扁板海绵属聚酮和氢醌-倍半萜的高效合成
环张力是指环状化合物由于偏离正常键角产生的扭曲和扭转张力。利用环张力作为驱动力,可从动力学和热力学两方面促进反应发生,实现常规条件下难以发生的化学转化。基于这一反应特性,唐叶峰课题组近年来围绕小环体系(如三、四元环)和反式中环烯烃体系(如反式环庚烯或反式环壬烯),发展了多种环张力驱动的环加成反应(图3A)和重排扩环反应(图3B),并将其应用于天然产物及其它活性分子合成以及生物正交化学,其中代表性的研究成果总结如下:1)以烯基环丁烷与氧气的形式[4+2]反应为关键步骤,实现了扁板海绵属聚酮类天然产物 (+)-gracilioether A及其同源物的首次全合成,同时也为此类环状过氧化合物提供了一种新颖高效的合成方法(J. Am. Chem. Soc. 2018, 140, 1937; Org. Lett. 2021, 23, 8783)(图3A);2)以环张力驱动的[1,2]-负离子重排/环丙烷碎裂化/环化反应为关键步骤,实现了氢醌-倍半萜dysiherbols A, C和D的高效合成以及结构修正(J. Am. Chem. Soc. 2022, 144, 19521)(图3B);该项研究揭示了一种以协同方式进行的[1,2]-负离子迁移反应,属于有机合成中非常罕见的“轨道对称性禁阻反应”,具有重要的理论研究意义和合成应用价值。
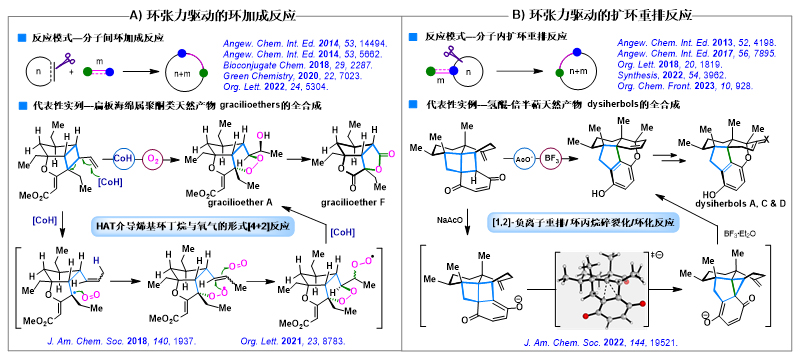
图3. 环张力驱动的构环反应研究及其在天然产物合成中的应用
3)发展简洁高效的仿生串联反应,实现细胞松弛素类天然产物的高效、集群式合成
细胞松弛素是一大类具有重要生物活性的真菌次生代谢产物,长期以来被视为发现新药和先导化合物的重要来源。近年来,我国科学家发现了一系列结构更为复杂的细胞松弛素二聚体、三聚体,大大丰富了此类天然产物的化学和生物多样性,同时也对合成化学家提出了更大的挑战。近年来,唐叶峰课题组围绕细胞松弛素类天然产物展开了系统深入的研究(图4),其中代表性工作如下:1)针对具有9/6/5、11/6/5和6/6/5等三环骨架的细胞松弛素单体,发展了新颖高效、且具有普适性的合成策略,完成了十多个代表性分子的全合成,最长线性步骤和效率均优于前人工作(Angew. Chem. Int. Ed. 2016, 55, 6992; Org. Lett. 2021, 23, 8783);2)利用一系列仿生串联反应,完成了多个结构更复杂、更具挑战性的细胞松弛素二聚体和三聚体的首次全合成,大大扩展了该类天然产物全合化学的边界(Angew. Chem. Int. Ed. 2018, 57, 14216);3)通过实验和计算化学手段,揭示了控制细胞松弛素二聚体仿生Diels-Alder反应区域和立体选择性的决定因素,为阐明细胞松弛素多聚体的生源合成途径提供了重要依据(Tetrahedron Chem. 2022, 2, 100022)。
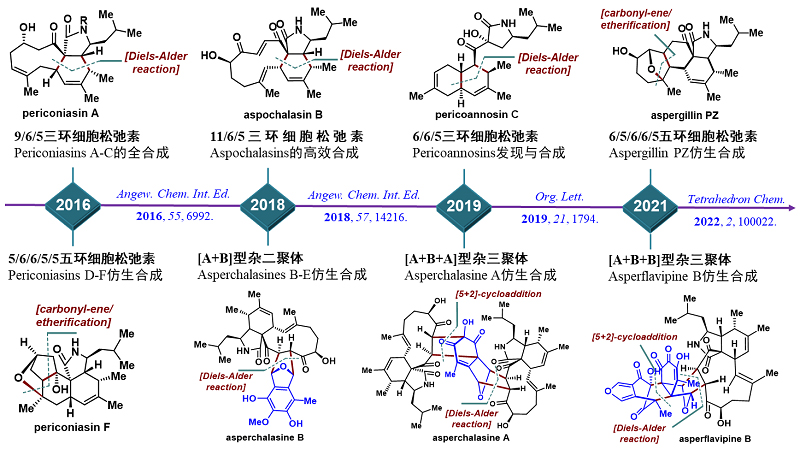
图4. 细胞松弛素类天然产物的仿生合成
(二)基于三氮唑开环化学的合成方法学研究
除了天然产物全合成以外,唐叶峰课题组还致力于发展新颖高效的合成方法学,用于构建各类天然产物或药物分子中常见的“优势骨架”,在实现化学创新的同时,也为相关药物化学研究提供了丰富的物质基础。尤其是该课题组近年来围绕“三氮唑脱氮气开环化学”这一主题,在发展方法、研究机理和合成应用等不同层面开展了一系列颇具特色的研究工作,其中代表性成果如下:
1)α-亚胺铑卡宾介导的环加成反应
作为国内较早开展α-亚胺铑卡宾化学研究的团队之一,该课题组发展了一系列α-亚胺铑卡宾介导的环加成反应,实现了多个具有高附加值的含氮杂环化合物库的构建(图5A),大大丰富了1,2,3-三氮唑开环化学。例如,该课题组首次实现了1,2,3-三氮唑和1,3-丁二烯的[4+3]环加成反应(Angew. Chem. Int. Ed. 2014, 53, 5662),为合成氮杂七元环提供了一种通用方法,相关研究论文入选本领域top 1%高被引论文。此外,该课题组报道了1,2,3-三氮唑和2H-氮杂丙烯啶的[3+2]环加成反应(Chem. Commun. 2015, 51, 4507),并首次提出α-亚胺金属铑卡宾可作为[2C]-合成子的合成理念,拓展了α-亚胺铑卡宾的反应性。
2)邻氨基芳基重氮盐介导的环加成反应和偶联反应
相比简单的1,2,3-三氮唑,苯并三氮唑化学性质更加稳定,因而关于其开环化学研究很少,合成应用价值也一直没有得到重视。唐叶峰课题组是国际上率先展开苯并三氮唑开环化学研究的研究团队之一,为克服苯并三氮唑固有的化学惰性,该课题组设计了一种“活化+稳定”双管齐下的活化策略(Chem. Sci. 2017, 8, 3852),在温和条件下实现了苯并三氮唑开环反应,并将原位产生的邻氨基重氮盐应用于过渡金属催化的偶联反应,得到各类邻氨基苯基衍生物。除作为[1C]合成子参与偶联反应外,苯并三氮唑还可作为[2C]和aza-[3C]合成子参与环加成反应,得到各类苯并杂环分子(Chem. Commun. 2017, 53, 11873; Org. Chem. Front. 2018, 5, 2815)(图5B)。在此项研究中,该课题组提出了“苯并三氮唑可作为邻氨芳基重氮盐等价物”的研究理念,对该领域的发展起到了积极的推动作用(Chem. Rec. 2020, 20, 693, 封面文章)。

图5. 基于三氮唑开环化学的合成方法学研究
(三)天然产物导向的新型生物正交反应研究
近年来,唐叶峰发挥课题组在合成化学方面的优势,从化学源头上设计和发展了一些兼具新颖性和实用性的生物正交反应,为生物大分子的动态修饰和调控提供了有力的工具。在研究思路上,该课题组独辟蹊径,首次明确提出了“自然启发的生物正交反应”这一概念,并利用自然界存在的一些高张力骨架或天然产物合成中发现的一些环张力体系作为生物正交合成子,实现了多个环张力驱动的生物正交反应,代表性工作包括:1)反式β-石竹烯和四嗪的逆电子Diels-Alder反应(Bioconjugate Chem. 2018, 29, 2287)(图6A);2)光诱导反式环庚烯酮和叠氮的[3+2]偶极环加成反应(Green Chem., 2020, 22, 7023)(图6B);3)pH-调控的反式环庚烯与四嗪的逆电子Diels-Alder反应(Org. Biomol. Chem. 2021, 19, 8343)(图6C;4)具有桥头反式双键的β-石竹烯衍生物与四嗪的逆电子Diels-Alder反应(Org. Lett. 2022, 24, 5304)(图6D)。上述研究工作层层递进,互为补充。例如,反式β-石竹烯是一种商业可得的天然产物,其骨架中包含一个具有高张力的反式环壬烯,相比常用的生物正交子,其优势在于原料便宜易得,生物兼容性好。对于光诱导反式环庚烯酮介导的[3+2]偶极环加成反应而言,由于环庚烯酮具有更大环张力,反应速率相比目前常用的反式环辛烯更高。此外,与铜催化的click反应相比,该反应可以通过控制光源实现时空调控。将亚硝基硫脲作为pH-开关引入生物正交反应,不仅提供了一种新的原位产生高张力反式环庚烯的方法,而且实现了通过调控pH值来控制生物正交反应进程的目的。将具有桥头反式双键的β-石竹烯衍生物引入生物正交化学,优点在于借助桥头碳效应增大反式双键的张力,从而获得更高的反应速率;同时,由于桥环骨架对反式双键的固定作用,此类结构表现出更加优异的生物兼容性。通过与清华大学杜鹃鹃课题组合作,上述生物正交反应已成功应用于蛋白、细胞和动物体内的荧光标记(图6E)。
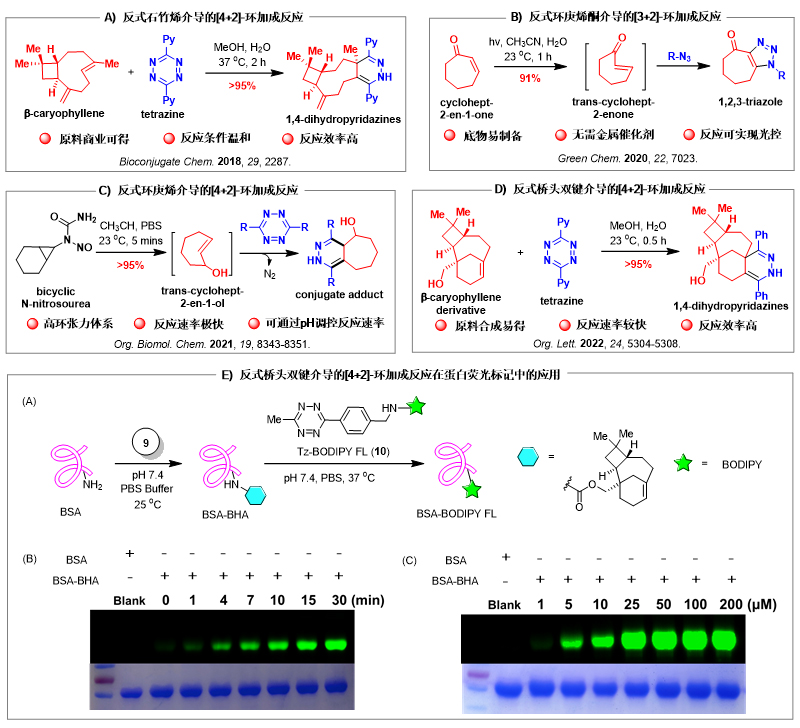
图6. 新型生物正交反应研究及应用
(四)抗病毒药物和抗神经退行性疾病药物研究
近年来,唐叶峰课题组围绕“抗病毒药物”和“抗神经退行性疾病药物”两个重点研究方向,通过多学科交叉合作,开展了一系列基于靶点的创新药物研究,并取得了一些阶段性研究成果(图7)。例如,该课题组和全球健康药物研发中心(GHDDI)的陈烁团队合作,围绕抗菌天然产物吲哚霉素进行了系统的药物化学研究,发现了一类靶向色氨酰tRNA合成酶(TrpRS)的新型抗结核活性分子,并在分子水平上揭示了其抑菌活性的作用机理,以及对结核分枝杆菌可能产生的抗药频率,为发展新型抗结核药物奠定了坚实的基础(ACS Chem. Biol. 2022, 17, 39)(图7A)。此外,该课题组与清华大学王戈林课题组合作,瞄准NAD代谢调控通路以及与衰老相关的神经退行性疾病等前沿热点,综合利用高通量药物筛选、基于结构的理性药物设计、药理学和代谢组学等多种技术手段,成功获得了靶向NAD生物合成限速酶烟酰胺磷酸核糖基转移酶(NAMPT)的新型小分子激活剂(NATs),为开发抗神经退行性疾病药物提供了理论依据和物质基础(Cell Res. 2022, 32, 570; Eur. J. Med. Chem. 2022, 236, 114260)(图7B)。鉴于此类小分子具有良好的应用开发前景,目前研究团体正积极与药物研发企业合作,力求在临床应用转化方面取得更大的突破。
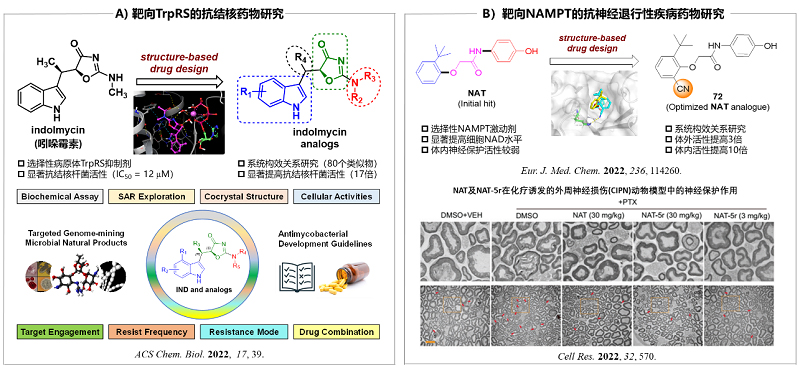
图7. 基于靶点的创新药物研究
导师介绍
唐叶峰
https://www.x-mol.com/university/faculty/17925
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号