Nat. Chem.:铜介导的脱羧偶联,光化学过程很关键
副标题:光诱导Cu(II)羧酸盐的LMCT过程,实现羧酸的脱羧交叉偶联
羧酸及其衍生物具有廉价易得、种类丰富、性质稳定等优点,因此,以之为原料的脱羧偶联反应已成为构建具有复杂结构和多样活性分子的有力工具。目前,最常见的现代脱羧偶联策略本质上是氧化还原中性的,即羧酸亲核体与亲电体的交叉偶联(图1a),并广泛应用于亲电体有机卤化物的C-C键构建中。相比之下,极性 C-N 和 C-O 键的构建通常需要使用内部氧化剂(如:羟基邻苯二甲酰亚胺(PINO)、碘烷酯)对羧酸进行预官能团化(图1b),导致反应步骤繁琐、产物纯化复杂。另一方面,Net-氧化脱羧交叉偶联不仅避免了预官能团化的需要,而且为安装简单的氮和氧亲核试剂提供了直接策略,其中最经典的方法是电解脱羧Kolbe反应,但是该过程需要溶剂量的杂核试剂作为牺牲氧化剂并且存在竞争的Kolbe二聚化。此外,不少课题组也报道过电催化脱羧醚的合成、电催化Ritter反应以及高温促进的过渡金属介导的氧化脱羧偶联,但是上述策略仍存在官能团耐受性差、预官能团化、化学选择性差、化学剂量的氧化剂等问题,从而严重阻碍了脱羧交叉偶联反应的发展。
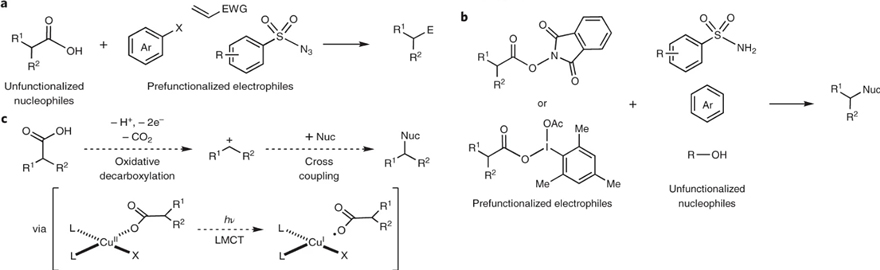
图1. 脱羧偶联反应的常见策略。图片来源:Nat. Chem.
2020年,Larionov课题组报道了一种金属光氧化还原策略,成功地实现了多种羧酸与芳胺的脱羧偶联(Angew. Chem. Int. Ed., 2020, 59, 7921–7927)。在此基础上,美国威斯康星大学麦迪逊分校的Tehshik P. Yoon教授(点击查看介绍)课题组设想能否利用Cu(II)盐内在的光化学性质,通过光诱导的配体-金属电荷转移(LMCT)过程来实现脱羧偶联反应?近日,他们在可见光照射下,实现了铜介导的羧酸与多种亲核试剂的氧化脱羧偶联反应(图1c)。初步机理研究表明该反应中的生色团是原位组装的Cu(II)羧酸盐物种,并且可见光诱导配体-金属电荷转移(LMCT)过程会导致自由基脱羧,从而引发氧化交叉偶联。相关成果发表在Nature Chemistry 上。
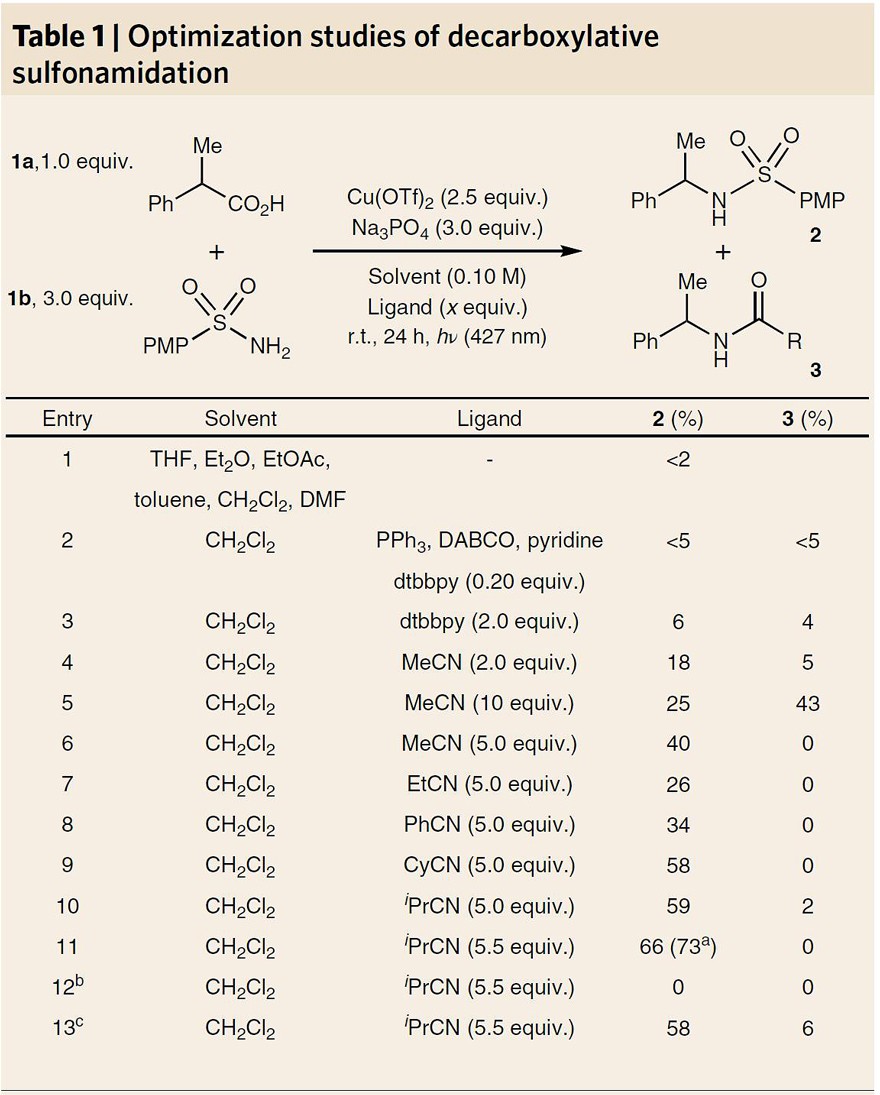
图2. 反应条件的筛选。图片来源:Nat. Chem.
鉴于磺酰胺类化合物在药物化学中具有重要的药物活性,作者选择1-苯基丙酸 (1a) 与 4-甲氧基苯磺酰胺 (1b) 为模型底物对脱羧偶联的反应条件进行了筛选(图2)。首先,在碱、Cu(OTf)2存在下用427 nm的LED灯照射时,在几种常见的有机溶剂中仅观查到痕量的产物(Entry 1);在Cu介导的转化中常见的单齿和双齿配体并不能促进反应的发生(Entry 2, 3),而乙腈作为配体则可以提高反应产率(Entry 4)。需要指出的是,该反应对乙腈极为敏感,5.0 equiv时反应效果最优,而用量较高则会生成Ritter加合物3。对腈配体结构的进一步研究表明,腈类配体i-PrCN(5.5 equiv)的反应效果最佳(Entry 7-11),能以 73% 的分离产率获得产物2。此外,对照实验表明该反应必须有光照条件(Entry 12)。最后,作者在大气环境下用未纯化的溶剂进行反应时,以58%的收率获得产物2(Entry 13),体现了该偶联反应的简单可操作性。
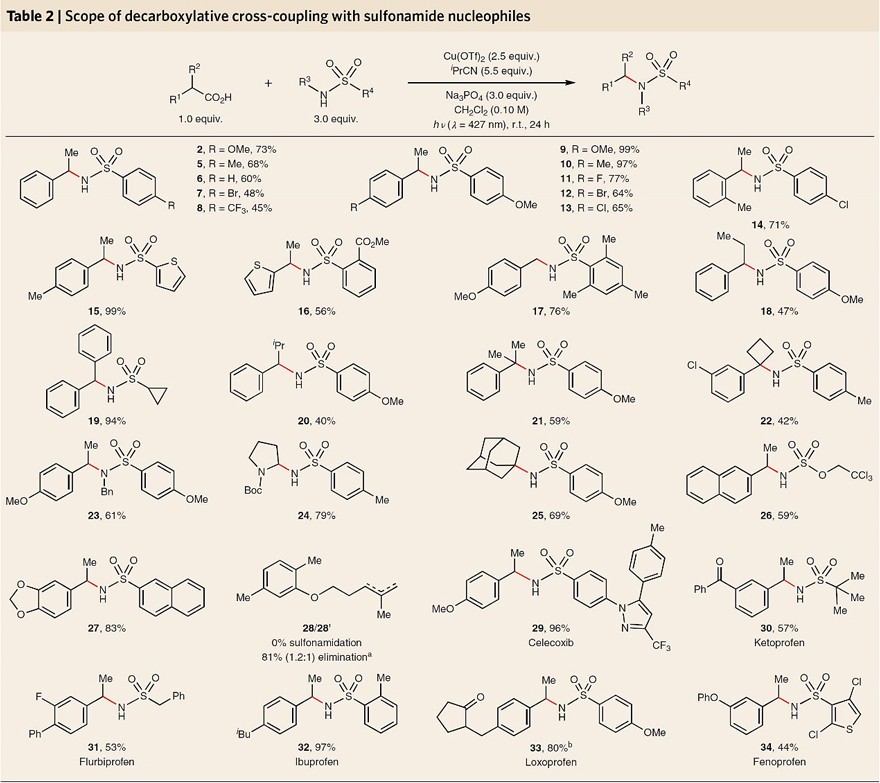
图3. 反应条件筛选。图片来源:Nat. Chem.
在最优条件下,作者对脱羧偶联反应的底物兼容性进行了考察(图3)。对于芳基乙酸底物而言,给电子基团取代的芳烃效果最优(9-13),特别是邻位甲基(14)、α-支链(18-22)取代的底物甚至α-氨基酸(24)均能兼容该反应,以中等至较好的产率得到所需产物。遗憾的是,不饱和脂肪族羧酸并不能参与该反应(28),其优先经历氧化消除而非亲核取代反应,但立体受限的金刚烷羧酸却能顺利进行反应(25,收率:69%)。另一方面,偶联试剂磺酰胺的底物范围也较广,无论是缺/供电子磺酰胺底物(2、5-8)还是杂芳基(15、34)和烷基(19、30、31)取代的伯磺酰胺甚至仲磺酰胺(23)均能实现这一转化,以良好的收率得到交叉偶联产物。此外,该反应还能耐受多种官能团,例如:芳基卤化物(7、11-14、34)、酯基(16)、氨基甲酸酯(24)、氨基磺酸酯(26)、缩醛(27)、多环芳烃(26、27)等。最后,作者发现该反应对新候选药物(29-34)的后期修饰也具有良好的反应性和官能团耐受性,进一步凸显了该反应的强大之处。
在羧酸与磺酰胺的脱羧交叉偶联反应成功实现后,作者对不同种类亲核试剂的反应性进行了探究(图4)。具体而言,将亲核试剂的比例降至1.5当量并在 MeCN中进行反应,便可使一系列氨基甲酸酯(35-38)和酰胺(39)亲核试剂顺利偶联。此外,无需外加亲核试剂,在腈溶剂中进行脱羧反应便可实现Ritter酰胺化反应(40-46),从而为芳基乙酸的 Curtius 重排提供了一种有吸引力的替代方案。此外,醇作为亲核试剂并不易偶联。为此,作者对反应条件进一步优化,以甲苯为溶剂、MeCN为配体、吡啶为碱性添加剂便可显著提高反应性能,从而顺利获得脱羧醚化产物(47-71),同时还具有良好的官能团耐受性,例如:末端烯烃(64、66)、杂环(63、69、70)、受保护的糖(70)、磺酰胺(69)、卤代烷(67)和炔烃(68)。最值得注意的是,该策略不仅局限于碳-杂键的构建,而且对碳-碳键的形成同样适用,例如,杂芳烃(72-74)和富电子芳烃(75)均能以良好的收率获得脱羧Friedel-Crafts烷基化产物。
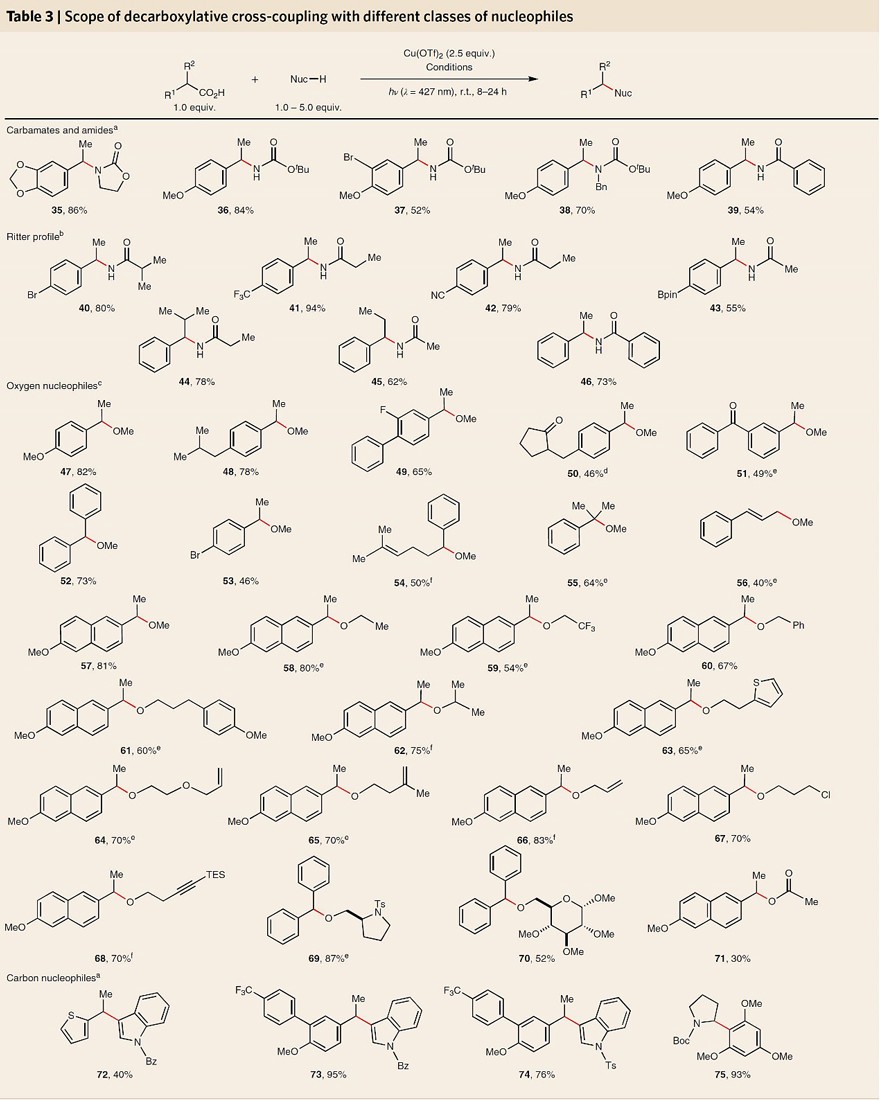
图4. 不同亲核试剂的交叉偶联反应底物拓展。图片来源:Nat. Chem.
最后,作者对反应机理进行了推测。如图5a所示,羧酸和Cu(OTf)2 在碱介导下原位组装成光活性生色团Cu(II)羧酸盐,后者在光激发下发生LMCT过程生成易于脱酸的羧基自由基,随后羧基自由基脱羧产生烷基自由基。接着,烷基自由基被Cu(II)氧化为碳正离子,并发生亲核取代获得最终的产物。为了进一步证实假设的反应机理,作者设计了如下实验:1)伯羧酸32a在 Ritter 酰胺化条件下获得脱羧自由基中间体的 5-exo-trig 环化产物76(图4b);而环丙基取代的乙酸 33a 在氧化醚化条件下则获得少量苄醚产物77(图5c)。这些结果为碳中心自由基中间体的参与提供了关键证据;2)紫外-可见滴定实验表明对应低能量吸收特征的单体物种负责脱羧偶联反应,这与经验优化的反应条件非常吻合(图5d)。低浓度1a-的加入会观察到λmax = 304 nm的吸收带变长,这与文献中报道的其他单体 Cu (II) 羧酸盐配合物的 LMCT 带相当。若1a-的浓度大于1当量时,Cu(II)导致上述特征消失并出现λmax= 260 nm的更高能带的增长,此处与桨轮Cu(II)羧酸盐二聚体的 LMCT 吸收带相当;3)随着1a浓度的增加,反应产率迅速下降,未反应的1a占大部分,并导致二聚体蓝移。若用254 nm光源照射(接近高能特征的 λmax)1a和1b时,仅形成痕量的2和苄基自由基二聚化产物78(图5e),而427 nm光源并不反应。基于以上结果,尽管多种Cu(II)羧酸盐物种均可产生自由基,但氧化和随后的亲核偶联仅发生在较低能量的可见光活化的配合物中。
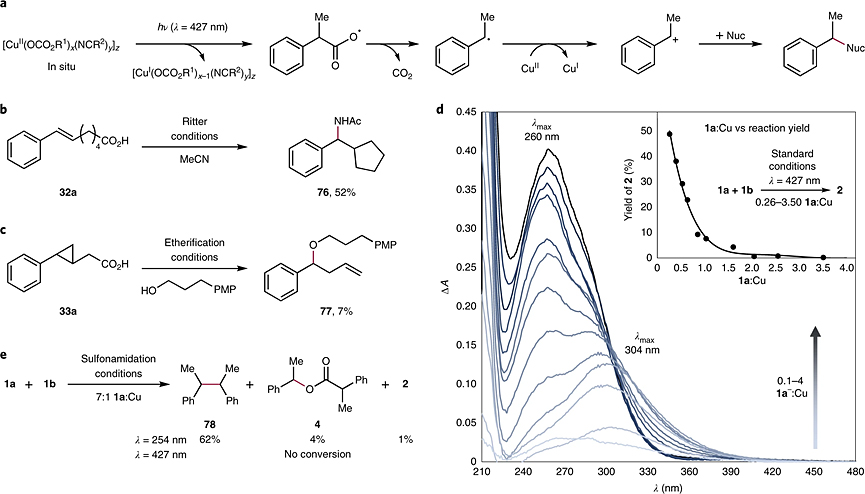
图5. 反应机理研究。图片来源:Nat. Chem.
总结
Tehshik P. Yoon教授课题组开发了一种铜催化的羧酸与各种氮、氧和碳亲核试剂的氧化交叉偶联策略。该体系利用原位生成的第一过渡金属配位络合物的固有光化学反应特性,并且无需外加贵金属光氧化还原催化剂便可进行光活化。该反应体系不仅适用于多种羧酸盐原料和亲核试剂,而且为复杂结构候选药物的合成和后期修饰提供了强大的工具。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Decarboxylative cross-nucleophile coupling via ligand-to-metal charge transfer photoexcitation of Cu (II) carboxylates
Qi Yukki Li, Samuel N. Gockel, Grace A. Lutovsky, Kimberly S. DeGlopper, Neil J. Baldwin, Mark W. Bundesmann, Joseph W. Tucker, Scott W. Bagley, Tehshik P. Yoon
Nat. Chem., 2022, 14, 94–99, DOI: 10.1038/s41557-021-00834-8
导师介绍
Tehshik P. Yoon
https://www.x-mol.com/university/faculty/108
(本稿件由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号