NHC催化构建轴手性芳基烯烃
轴手性骨架不仅是众多手性配体和手性催化剂的核心结构,而且广泛存在于天然产物和生物活性分子中,近年来在医药和农药研发领域也日渐受到关注。因此,催化不对称合成各类轴手性化合物吸引了众多有机化学家的关注。目前,关于轴手性化合物的研究主要集中在双芳基轴手性分子(axially chiral biaryls),其手性轴建立在两个芳香环中间,骨架相对比较稳定。而对于手性轴建立在芳环与开链烯烃之间的轴手性芳基烯烃(axially chiral styrenes)的研究则报道则较少。这类轴手性分子旋转能垒较低、稳定性差,在合成中难以控制立体选择性。因此,催化不对称合成轴手性芳基烯烃具有较大的挑战性(图1)。
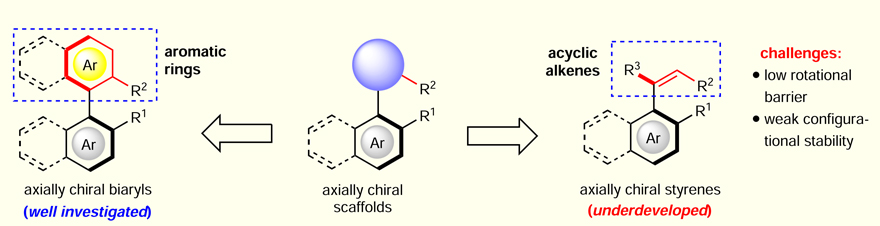
图1. 轴手性芳基烯烃的合成挑战性
池永贵教授(点击查看介绍)团队致力于在有机合成方法学和绿色农药研发生产领域开展原创性工作。在方法学方面,该团队系统设计发展了氮杂环卡宾(NHC)催化的新型活化模式及合成策略,并用于医药农药功能分子的快速构建。近日,该团队通过NHC催化实现了对轴手性芳基烯烃的高效不对称合成,制备出一系列含砜的轴手性芳基烯烃化合物(图2)。该反应具有高度的对应选择性和双键E式选择性,其关键步骤涉及亚磺酸根负离子对acetylenic acylazolium中间体的立体选择性1,4-加成及后续的E式选择性的质子化来建立手性轴。
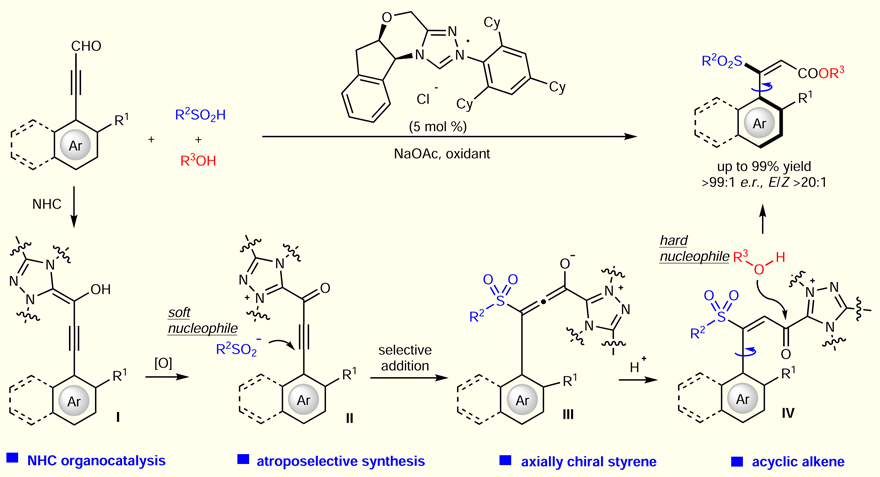
图2. NHC催化构建轴手性芳基烯烃
该反应具有良好的底物适用范围,不同取代的芳基亚磺酸以及烷基亚磺酸都能参与该反应,并且具有较高的收率和优秀的立体选择性(图3a)。各种不同取代的芳基炔醛也能较好的适应该反应体系,包括萘环骨架的炔醛和杂环骨架的炔醛(图3b)。值得注意的是,该反应可适用于大量合成(3 mmol scale),产物经过简单转化可以制备出多种不同类型的轴手性烯烃化合物。
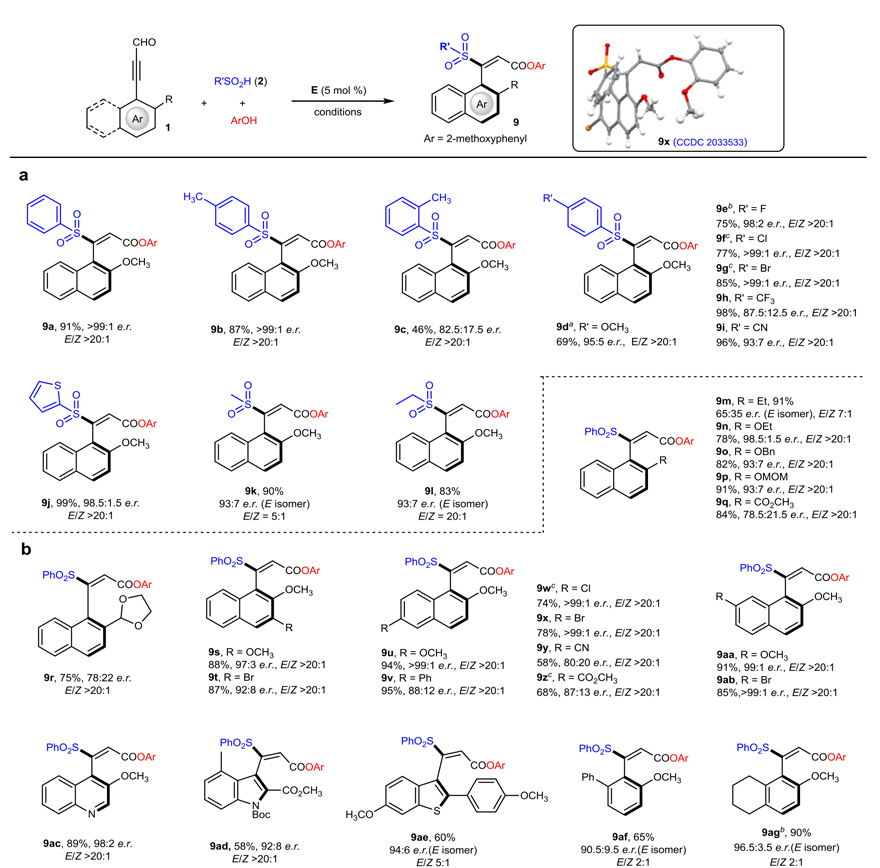
图3. 反应底物范围考察
该团队通过实验测量和DFT计算对所制备的轴手性芳基烯烃类化合物进行了稳定性评估。化合物9a、9n-9o在不同温度下随着时间变化的消旋曲线如图4a所示,据此可分析计算出9a、9n-9o的旋转能垒(图4b)。通过DFT计算所得化合物9a的旋转能垒与实验测量的结果相当。该反应所得的轴手性芳基烯烃类化合物在较低温度下具有很好地稳定性。
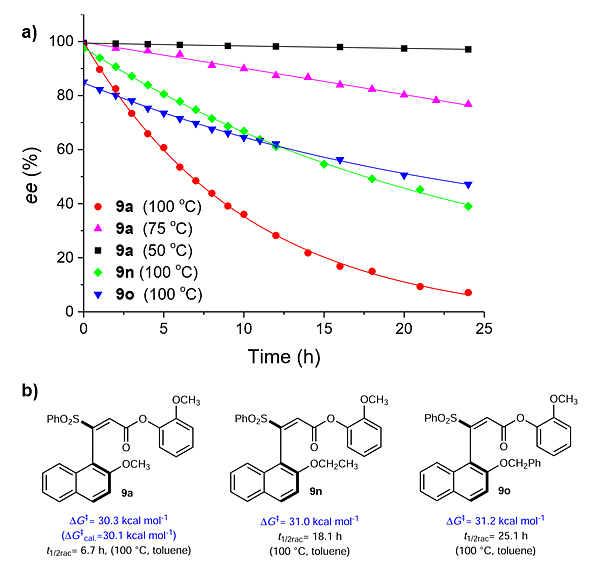
图4. 轴手性芳基烯烃的稳定性与旋转能垒
反应的历程如图5所示,首先NHC对芳基炔醛进行加成,形成Breslow中间体I,随后中间体I在氧化剂的作用下转化为acetylenic acylazolium中间体II;进而亚磺酸根负离子对中间体II进行1,4-加成后得到联烯醇中间体III,再经过E式选择性的质子化后,得到acylazolium中间体IV; 最后中间体IV在酚类亲核试剂的进攻下得到目标轴手性化合物,并释放出NHC催化剂。
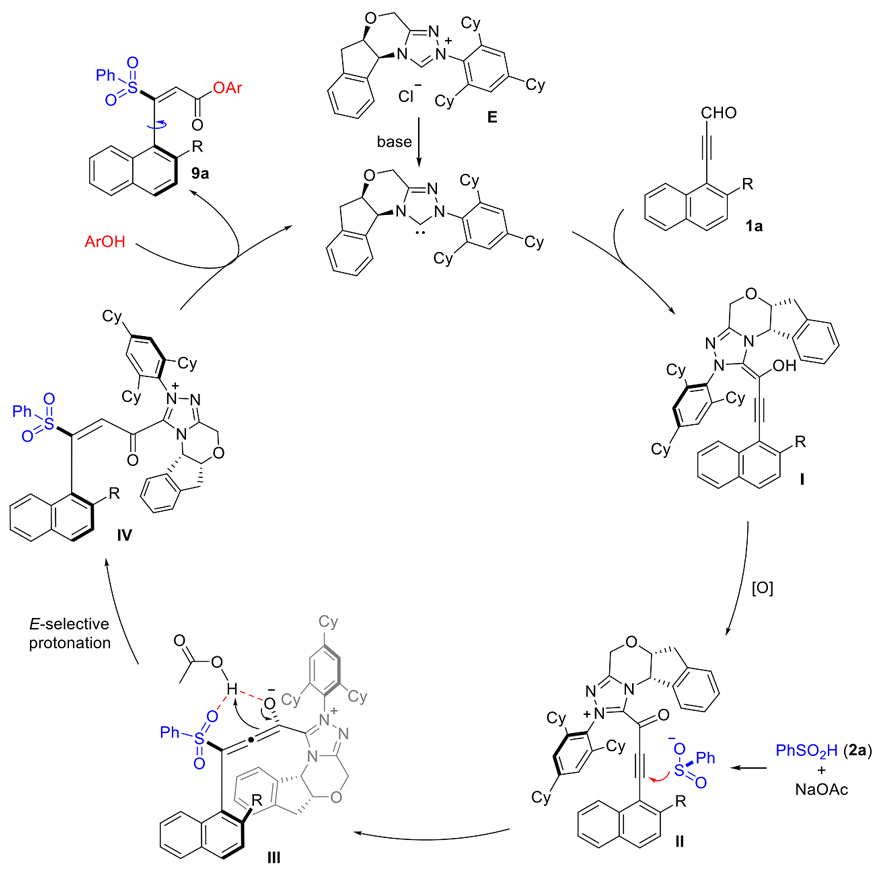
图5. 反应机理
该NHC催化的不对称反应为构建轴手性芳基烯烃提供了一条新的合成思路。该反应条件温和,操作简单,底物适用范围广,可用于多种轴手性芳基烯烃类化合物的合成,在轴手性分子骨架的构建方面具有重要的应用前景。
这一工作近期发表在Nature Communications 上,闫加磊博士为论文第一作者。贵州大学、贵州中医药大学及南洋理工大学的多位学生与研究人员在反应设计、底物拓展、合成应用、机理研究、生物活性探索等方面做了重要贡献。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Carbene-catalyzed atroposelective synthesis of axially chiral styrenes
Jia-Lei Yan†, Rakesh Maiti†, Shi-Chao Ren, Weiyi Tian*, Tingting Li, Jun Xu, Bivas Mondal, Zhichao Jin & Yonggui Robin Chi*
Nat. Commun., 2022, 13, 84, DOI: 10.1038/s41467-021-27771-x
导师介绍
池永贵
https://www.x-mol.com/university/faculty/4432
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号