NUS卢一新教授团队Chem:N-N键轴手性化合物的设计与选择性合成
阻转异构(Atropisomerism,也称轴手性)是自然界中普遍存在的现象之一,通常是由于取代基的位阻等原因,当分子中围绕某个特定单键的自由旋转受到阻碍且发生旋转的能垒足够大时,就有可能拆分出一对阻转异构体。近年来,阻转异构体(轴手性配体)不仅广泛应用于不对称催化与合成中,而且在天然产物、制药工业以及新材料(如:分子器件与功能材料)的合成中也得到越来越多的应用。目前,轴手性骨架主要有以下几种类型(图1A):1)C-C键连接的轴手性联芳基、苯乙烯和芳基酰胺骨架,例如:BINOL、NOBIN、BINA;2)C-X(如:N、O、S)键连接的轴手性,例如:C-N键轴手性配体与Murrastifoline F等等。鉴于轴手性化合物的重要性和普遍性以及它们在药物化学和不对称催化领域中的应用,因此开发新型轴手性化合物至关重要。
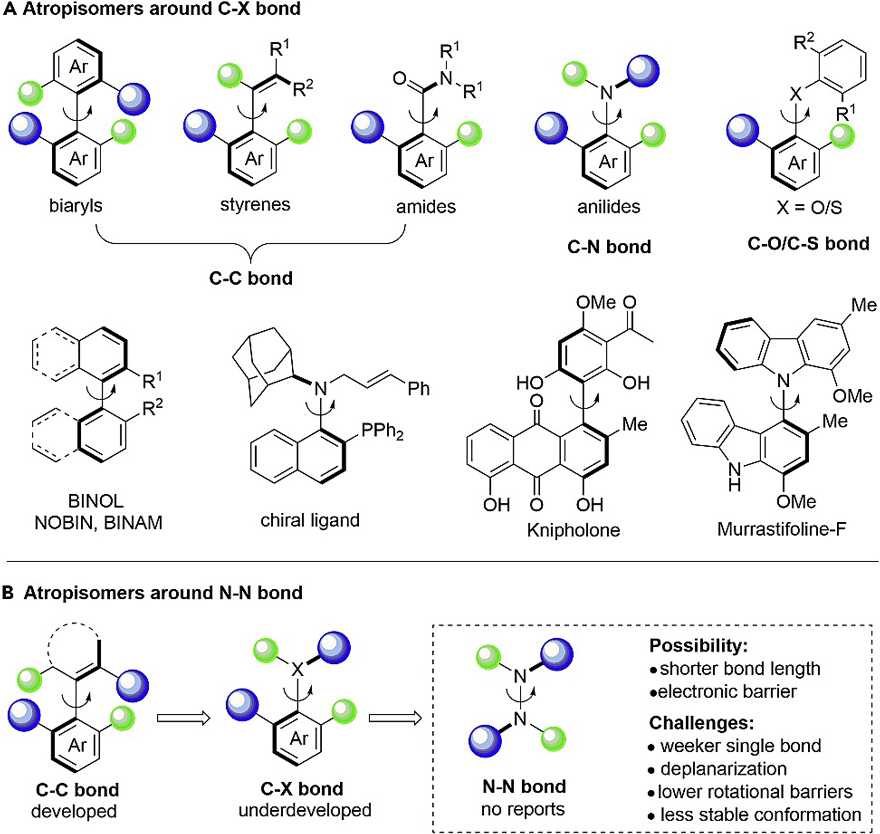
图1. 轴手性化合物。图片来源:Chem
除了上面介绍的几类轴手性化合物外,N-N键轴手性化合物也是一类具有高生物活性的重要化合物,并广泛存在于许多天然产物和药物分子中(图2A、2B)。然而,由于N-N键去平面化时会导致旋转能垒相对较低以及构象不稳定等问题,因此目前尚未报道过N-N键轴手性的构建(图1B)。在此基础上,新加坡国立大学的卢一新教授(点击查看介绍)团队基于N-N键键长较短、轴线较拥挤以及孤对电子的相互排斥作用等优点,通过奎宁丁催化的N-烯丙基烷基化反应,首次实现了1-氨基吡咯体系和3-氨基喹唑啉酮体系N-N键轴手性骨架的构建(图3),并利用DFT计算对其手性起源进行了解释。该反应不仅条件温和、官能团耐受性好,而且具有优异的收率和对映选择性。相关成果发表在Chem上。郑州大学化学学院学科骨干特聘教授梅光建博士为第一作者,加州大学洛杉矶分校的K. N. Houk教授与新加坡国立大学的卢一新教授为论文共同通讯作者。
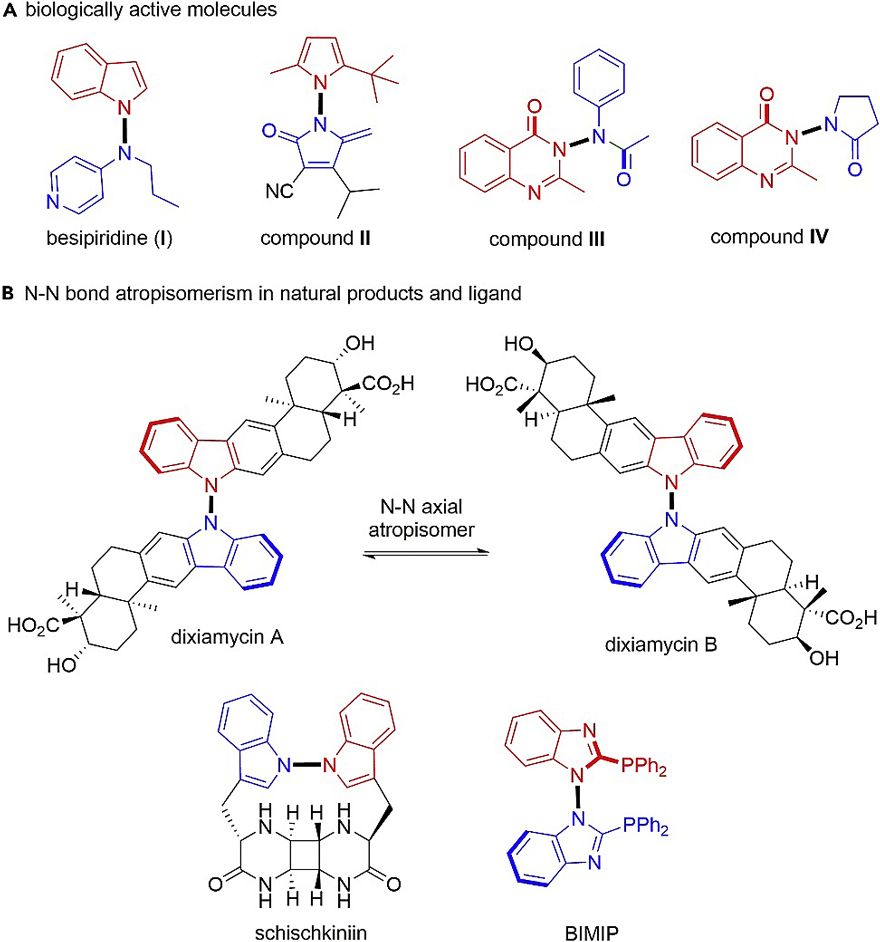
图2. N-N轴手性活性分子、天然产物与配体。图片来源:Chem
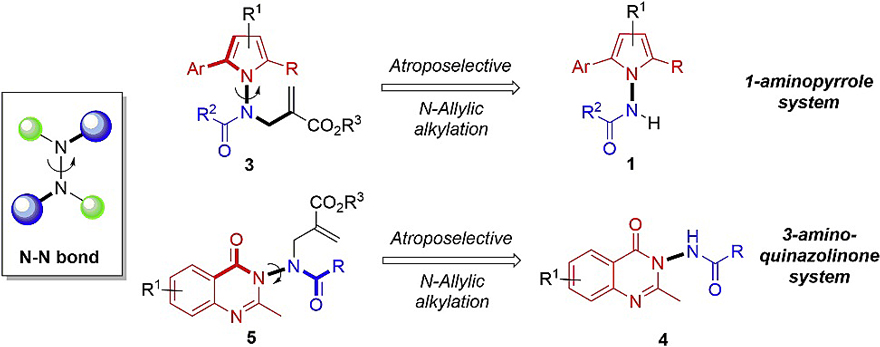
图3. N-N轴手性骨架的构建。图片来源:Chem
(一)1-氨基吡咯体系N-N键轴手性骨架的构建
首先,作者选择1-氨基吡咯1a为模板底物、Morita–Baylis–Hillman(MBH)加合物2a为烷化剂,对N-烯丙基烷基化的反应条件进行了探索(图4)。结果显示4-二甲氨基吡啶(DMAP)能够有效地催化1a和2a之间的反应,以极好的产率获得所需的N-烷基化产物3a,但是ee值为0(entry 1)。有趣的是,当选用辛可宁(A)为催化剂时,1a能以95%的产率和70% 的ee值顺利地转化为烷基化产物3a(entry 2)。在对喹啉型生物碱的种类、溶剂等因素进行筛选后(entries 2-11),作者确定了最佳条件:即1a和2a 在10 mol% D(quinidine)为催化剂、三氯甲烷为溶剂的条件下于室温反应12 h(entry 9),能以96%的产率与94% 的ee值获得产物3a。
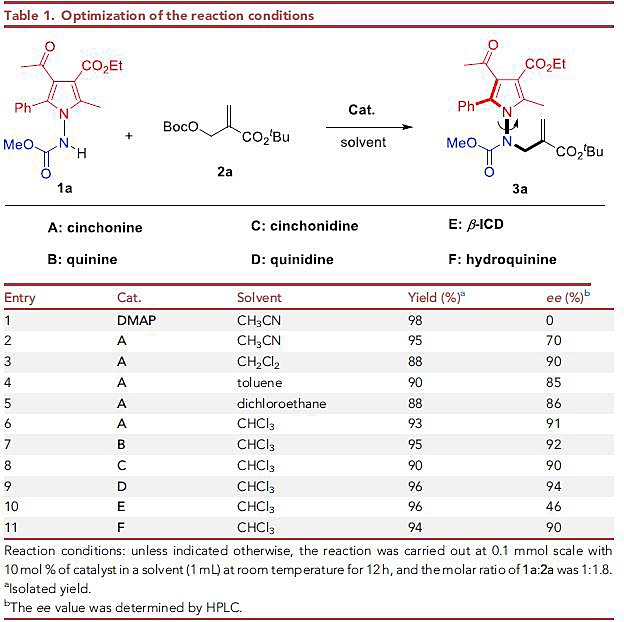
图4. 反应条件筛选。图片来源:Chem
在最优的反应条件下,作者对底物范围进行了考察(图5)。首先,作者研究了MBH加合物2的底物范围,结果显示不同类型的酯基(如叔丁基3a、甲基3b、乙基3c、苄基3d、二苯甲基3e和9-甲基蒽3f)都能兼容该反应,以优异的收率和对映选择性获得相应产物。类似地,氨基甲酸酯的酯基部分也具有良好的耐受性(3g、3h)。值得一提的是,1-氨基吡咯中氨基邻位取代基的大小(3i、3j)以及吡咯环上取代基的电性和位置(3k-3o)对反应的影响不大,均能以优异的产率和对映选择性获得相应的N-N键轴手性产物。其次,作者对吡咯2-位芳香取代基的耐受性进行了考察(图5),结果表明所有的底物均可以优异的收率和良好的对映选择性获得相应的轴手性产物。需要指出的是,与含有缺电子芳香取代基的底物相比,富电子芳基取代的吡咯具有更高的对映选择性。此外,含有双取代苯基(3y-3c')、2-萘基(3d')、2-呋喃基(3e')和2-噻吩基(3f'-3g')的吡咯底物均能实现这一转化,但含有4-吡啶基的吡咯产物(3h')却只有中等的ee值。值得注意的是,具有庞大邻位取代基的烷基化产物3w和3x并不具有C-C键轴手性。
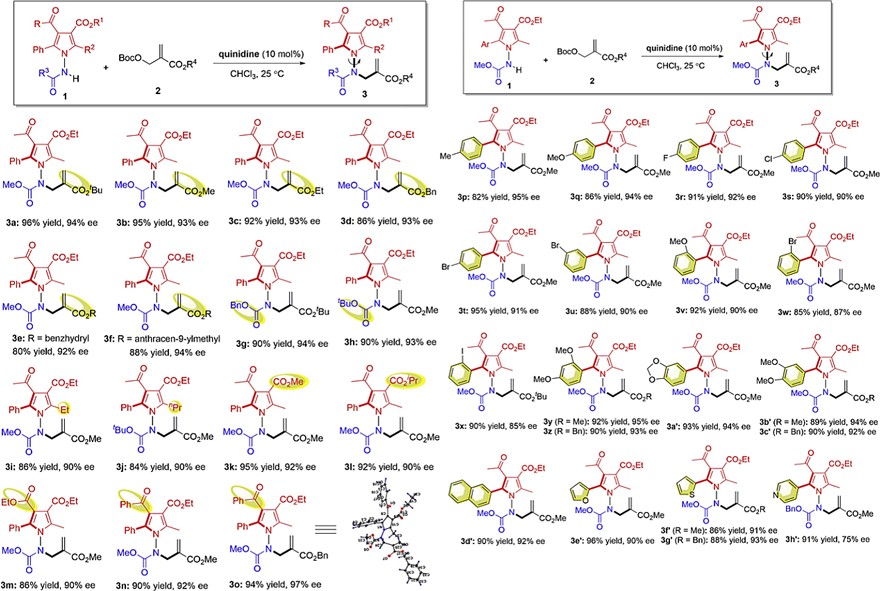
图5. 底物拓展。图片来源:Chem
(二)3-氨基喹唑啉酮体系N-N键轴手性骨架的构建
喹唑啉酮骨架是天然产物、生物活性分子以及手性配体中常见的结构单元。近年来,化学家对其手性骨架的构建及其催化反应进行了许多的探索,但有关N-N键轴手性喹唑啉酮的对映选择性合成仍然未知。基于此,作者通过3-氨基喹唑啉酮4的对映选择性N-烯丙基烷基化,成功地实现了3-氨基喹唑啉酮体系N-N键轴手性骨架的构建(图6)。其次,对反应条件进行筛选后,作者确定了最优的反应条件:即3-氨基喹唑啉酮4和MBH加合物2在10 mol% (quinidine)为催化剂、氯苯为溶剂的条件下于-20℃反应48 h,以86%的收率和95% 的ee值获得3-氨基喹唑啉酮5a。最后,在最优条件下,作者以优异的收率和对映选择性合成了一系列不同基团取代的N-N键轴手性3-氨基喹唑啉酮类化合物(5a-5o)。值得注意的是,氮原子的保护基可以是酯基(5a-5c)、乙酰基(5d),也可以是苯甲酰基(5e-5l)等。此外,喹唑啉酮的苯环上也可以耐受不同的官能团(5m-5o)。然而,当使用2-苯基取代的3-氨基喹唑啉酮(5p)进行反应时,其产物的收率较高,但对映选择性有所降低。
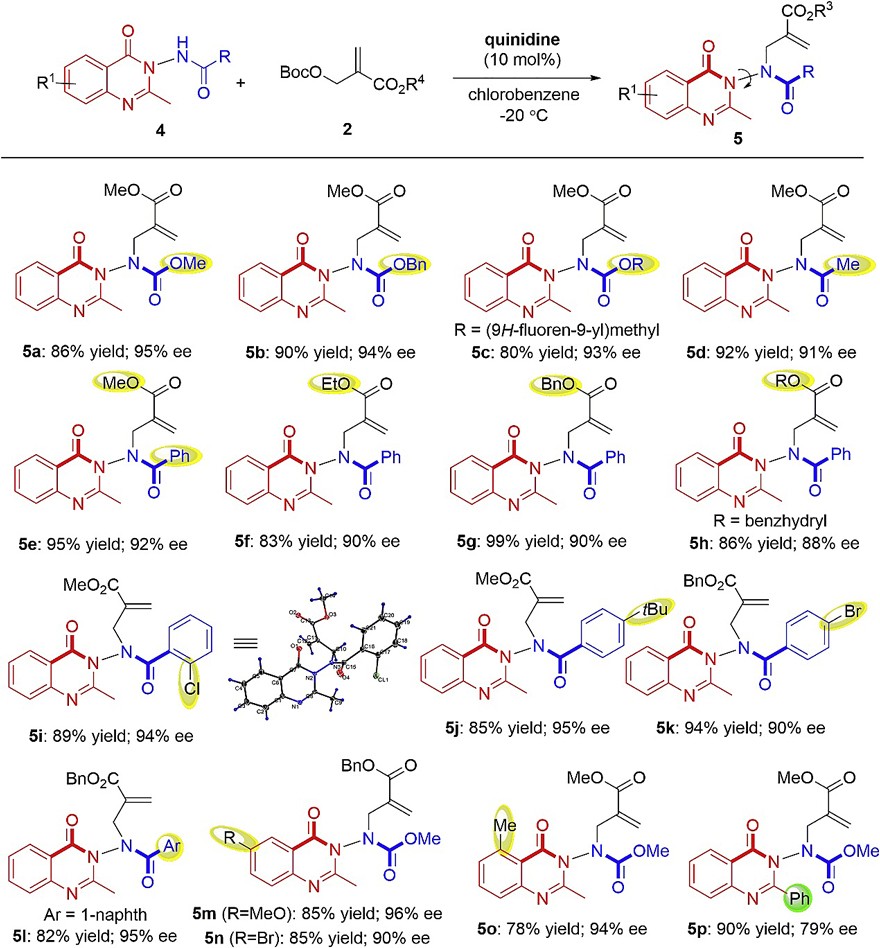
图6. 底物拓展。图片来源:Chem
为了进一步理解N-N键轴手性产物1-氨基吡咯与3-氨基喹唑啉酮体系的构型稳定性,作者进行了外消旋化实验和密度泛函理论(DFT)计算以获得旋转势垒(图7)。研究结果表明: 1)1-氨基吡咯3b与3-氨基喹唑啉酮5j的ee值分别在135℃和110℃时随时间的推移而下降(图7C);2)分别测定了3b、3m'、5a、5e和5j 的旋转势垒(图7D);3)由于“支撑效应(buttressing effect)”的作用,导致1-氨基吡咯在构型上比3-氨基喹唑啉酮更稳定。在完全取代的吡咯环中,2位与5位的取代基被推向N-N键附近,导致更拥挤的共面过渡态,因此具有更高的旋转势垒;4)在3-氨基喹唑啉酮体系中,喹唑啉酮的氧原子与N-氨基甲酰基氧之间的电子对排斥作用以及5e和5j中 N-芳酰基中羰基的灵活取向,导致5a的旋转势垒高于5e与5j。此外,作者在标准反应条件下进行了克级规模合成,以85%的收率和92% 的ee值得到了1-氨基吡咯3d,并且3d还能以优异的收率和对映选择性进一步转化为相应的还原产物7和双羟基化产物6(图8)。

图7. N-N键轴手性稳定性的实验。图片来源:Chem
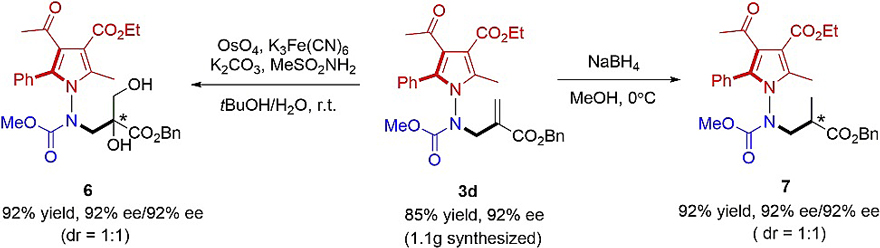
图8. 克级规模反应与衍生化。图片来源:Chem
在获得产物的旋转势垒后,作者对N-N键轴手性的起源进行了进一步研究,结果表明:1)1-氨基吡咯体系的轴手性控制远离反应位点 (图9A);2)吡咯环C3-或C4-位上较远的官能团(FGs)会显著影响奎尼丁催化剂向前手性N-N轴的手性转移(图9B),并且对映选择性(ee值)会随着C4位酯基空间位阻的增加而降低(图9B);3)C3位的吸电子基团(EWGs)在对映体的控制中起着关键作用(图9C),例如:将EWG改为H(3j')或氰基(3k')都会显著降低对映选择性;4)在当前反应体系中,吡咯C4-位烷氧羰基的存在对立体化学的控制至关重要,并且对N-N键轴手性的远程控制是由空间位阻及其它因素共同决定的(图9D)。最后,作者与Houk计算化学团队合作研究(图10),证实了N-N键轴手性是由空间位阻以及手性催化剂和底物之间的氢键作用共同决定的。

图9. 1-氨基吡咯N-N轴手性的远程控制。图片来源:Chem
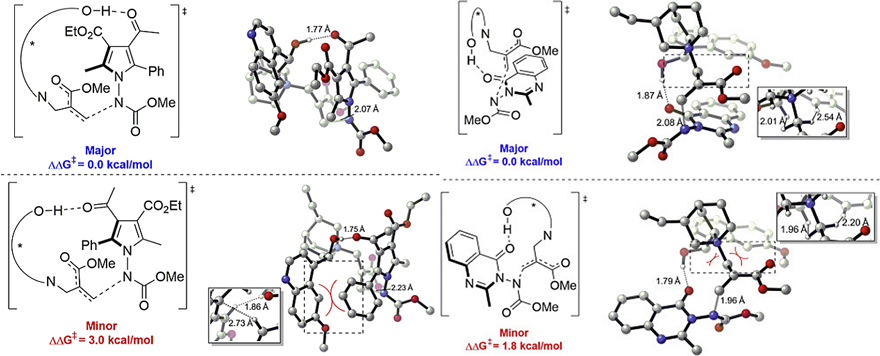
图10. 过渡态研究。图片来源:Chem
总结
卢一新教授团队首次设计并合成了N-N键阻转异构体。具体而言,通过奎宁丁催化的N-烯丙基烷基化反应,实现了1-氨基吡咯体系和3-氨基喹唑啉酮体系N-N键轴手性骨架的构建。该反应不仅条件温和、官能团耐受性好,而且为手性分子的合成开辟了新的途径,并将在药物开发和配体开发等方面有着更重要的应用前景。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Rational design and atroposelective synthesis of N–N axially chiral compounds
Guang-Jian Mei, Jonathan J. Wong, Wenrui Zheng, Anjanay A. Nangia, K.N. Houk, Yixin Lu
Chem, 2021, DOI: 10.1016/j.chempr.2021.07.013

卢一新
https://www.x-mol.com/university/faculty/78603
课题组主页
https://blog.nus.edu.sg/e0220151/home/
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号