中科院医学所程向东/覃江江团队:小分子靶向信号传导和转录激活因子STAT3的研究进展
信号传导和转录激活因子STAT家族(包含STAT1、STAT2、STAT3、STAT4、STAT5α、STAT5β和STAT6 七个成员)是一类重要的蛋白,主要负责调控细胞周期、生长和免疫反应等生命活动。其中,STAT3蛋白在多种肿瘤组织(约占70%)中高表达,与预后差密切相关。其涉及的机制包括:促进肿瘤干细胞增殖、上调Bcl-xL、Mcl-1、Bcl-2等抗凋亡相关的蛋白、诱导基质金属蛋白酶如MMP-1、MMP-2和MMP-9等表达而促进肿瘤细胞侵袭转移、以及下调促炎细胞因子/趋化因子促进免疫逃逸等。鉴于STAT3在肿瘤发生发展中的重要作用,设计靶向STAT3的选择性小分子抑制剂或者降解剂是肿瘤治疗的潜在策略,也是近二十年来研究的热点之一。近日,中国科学院基础医学与肿瘤研究所程向东教授/覃江江研究员团队总结了近几年小分子靶向信号传导和转录激活因子STAT3的抑制剂/降解剂研究现状、构效关系及设计策略。
在结构方面,STAT3蛋白约由770个氨基酸组成,可分为NTD、CCD、DBD、LD、TAD和SH2六个结构域。每一个结构域在信号转导和转录因子激活过程中扮演了不同的角色:NTD主要负责STAT3二聚体的核转移与DNA结合;CCD主要负责招募STAT3与受体结合;DBD可以与特定的DNA序列结合;LD用来连接DBD与SH2结构域;TAD内氨基酸残基Y705 和 S727是磷酸化的重要位点;SH2影响STAT3二聚化的形成。其中,SH2是STAT家族中非常保守的结构域,包含pY、疏水性的pY+1和pY-X三个结合口袋。
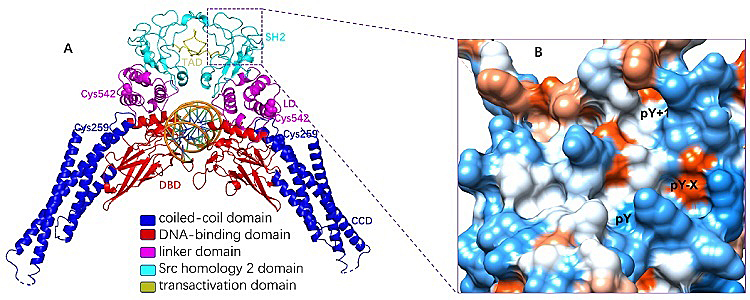
图1. STAT3蛋白的结构
目前有多种化合物报道具有STAT3抑制活性。基于它们的结构特征,作者从苯并噻吩砜类、磺酰胺类、醌类、黄酮类、萜类,杂环类等方面分别阐述了这些抑制剂的发现、设计策略及生物活性(或构效关系)。从作用位点来说,当前报道的抑制剂多数作用于SH2结构域,且设计的原则是尽量占据SH2三个结合口袋。尽管DBD结合位点相对较浅,但作用该位点的抑制剂也有报道,如C48、MMPP、inS3-54和inS3-54A18等。此外,尚有少数的化合物是通过与STAT3蛋白Cys残基发生共价结合而发挥抑制作用。
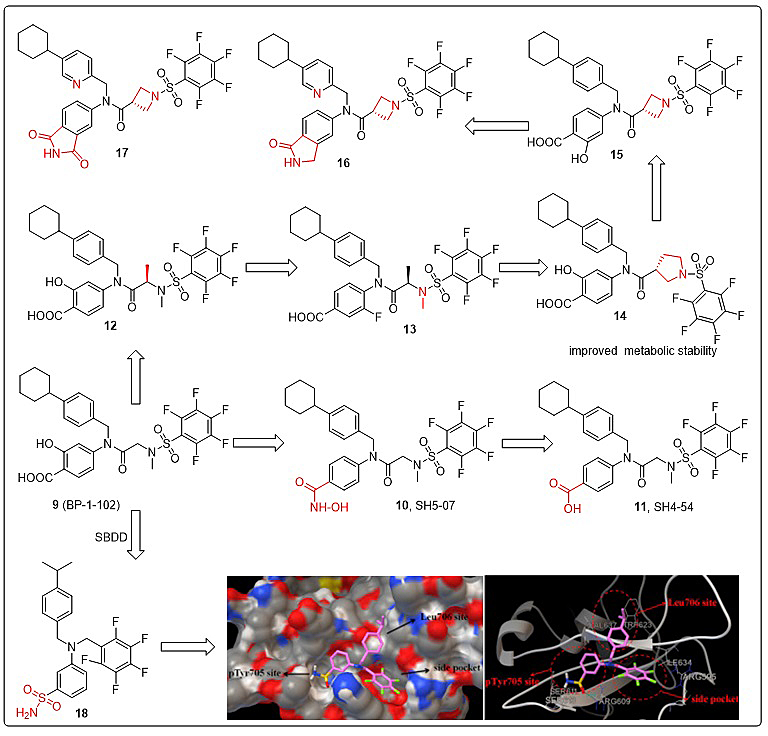
图2. 代表性STAT3抑制剂
靶向嵌合体技术(PROTAC)是近年来药物研发领域受到极大关注的一种降解技术,其利用E3泛素连接酶和泛素-蛋白酶体系统介导靶蛋白降解。除抑制STAT3功能外,利用PROTAC降解技术开发STAT3降解剂被证明是另外一种有效的策略。与抑制剂相比,PROTAC降解剂有很多特有的优势,但也面临诸多的挑战,特别是STAT3配体的选择以及Linker 的优化。
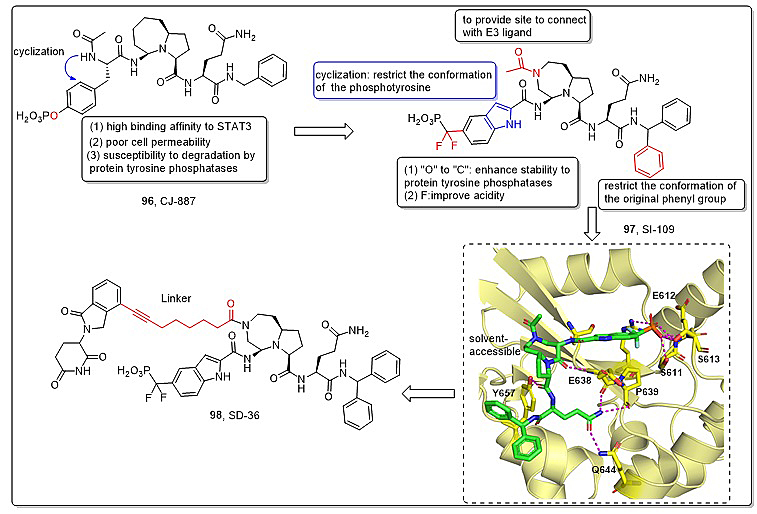
图3. 代表性STAT3降解剂
综上所述,STAT3是一个很有药物开发前景的靶标。虽尚未有药物上市,但已有多种STAT3抑制剂进入临床试验阶段,或单药或联合给药。我们预见未来将有更多的STAT3抑制剂/降解剂应用于临床。
这一成果近期发表在Journal of Medicinal Chemistry上,文章第一作者为董金云助理研究员,通讯作者为覃江江研究员。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Recent Update on Development of Small-Molecule STAT3 Inhibitors for Cancer Therapy: From Phosphorylation Inhibition to Protein Degradation
Jinyun Dong, Xiang-Dong Cheng, Wei-Dong Zhang, and Jiang-Jiang Qin*
J. Med. Chem., 2021, 64, 8884–8915, DOI: 10.1021/acs.jmedchem.1c00629
覃江江研究员介绍

覃江江,博士,2011年毕业于上海交通大学,师从张卫东教授。现任中国科学院基础医学与肿瘤研究所研究员,博士生导师,浙江省海外高层次人才,浙江省杰青,致力于消化道恶性肿瘤发生发展分子机制研究及抗肿瘤药物开发。近三年以第一作者或通讯作者在Drug Resistance Updates、Molecular Cancer、Cancer Research、Drug Discovery Today、Journal of Medicinal Chemistry等期刊上发表多篇论文。
课题组长期招聘分子生物学、细胞生物学、肿瘤免疫学、药物化学、药理学等专业博士后,欢迎咨询(jqin@ucas.ac.cn)。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号