ACS Appl. Bio Mater. 封面 ǀ 鼻咽良性细胞及癌细胞在微格栅结构上的铺展和迁移行为研究
英文原题: Spreading and Migration of Nasopharyngeal Normal and Cancer Cells on Microgratings

通讯作者: Raymond H. W. Lam (林晓维), Department of Biomedical Engineering, City University of Hong Kong, Hong Kong SAR, China; Stella W. Pang (彭慧芝), Department of Electrical Engineering, City University of Hong Kong, Hong Kong SAR, China
作者: Yi Liu (柳毅), Jifeng Ren (任冀峰), Ruolin Zhang (张若琳), Shuhuan Hu (胡书环), Stella W. Pang (彭慧芝), Raymond H. W. Lam (林晓维)
近日,香港城市大学生物医学工程系林晓维副教授研究团队报道了鼻咽癌细胞及良性上皮细胞在微米格栅结构上的细胞铺展及迁移行为研究结果。
鼻咽癌(NPC)是我国华南地区以及东南亚地区常见的一种区域病,具有较高的侵袭率和远处转移率。据报道,有4-10%的鼻咽癌患者在初诊时出现同步转移(smNPC)。随着医学成像和诊断技术的进步,大量临床数据表明中期(II-III)的鼻咽癌患者会出现肿瘤细胞侵入咽部和附近肌肉组织的现象,甚至会转移并扩散到远处部位(如肝和肺)。尽管有现有的生物标志物,例如爱泼斯坦-巴尔病毒(EBV)表达的miRNA(即BamHI-A右向转录)和转移性肿瘤抗原1(MTA1)可以指示鼻咽癌的发病机理和转移,但促进鼻咽癌表现出这种侵袭和转移行为的潜在机制仍未确定。此外,许多临床证据表明鼻咽癌的侵袭和转移可引起肌肉组织的病理变化,甚至引起肌肉坏死。所以研究癌细胞附着在新的集落(即翼状肌)上并增殖形成继发肿瘤时的行为是有重要意义的。
细胞铺展和迁移在许多疾病如肿瘤转移中起着关键作用。特别是鼻咽肿瘤细胞有迁移到翼状肌和进一步向远处转移的趋势。尽管现有研究已经揭示了鼻咽肿瘤细胞的关键特征,但它们的迁移偏好尚未被深入了解,尤其是在包括微米拓扑结构因素在内的生物力学方面。近年来,已有研究人员报道了研究与微米拓扑结构相关的细胞行为的技术,但尚未将其用于鼻咽肿瘤细胞的研究。
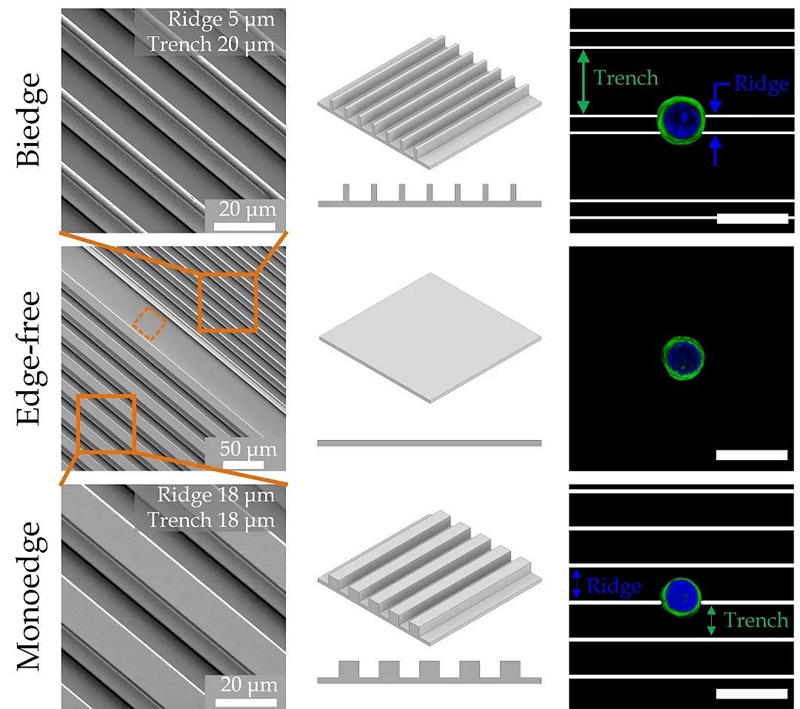
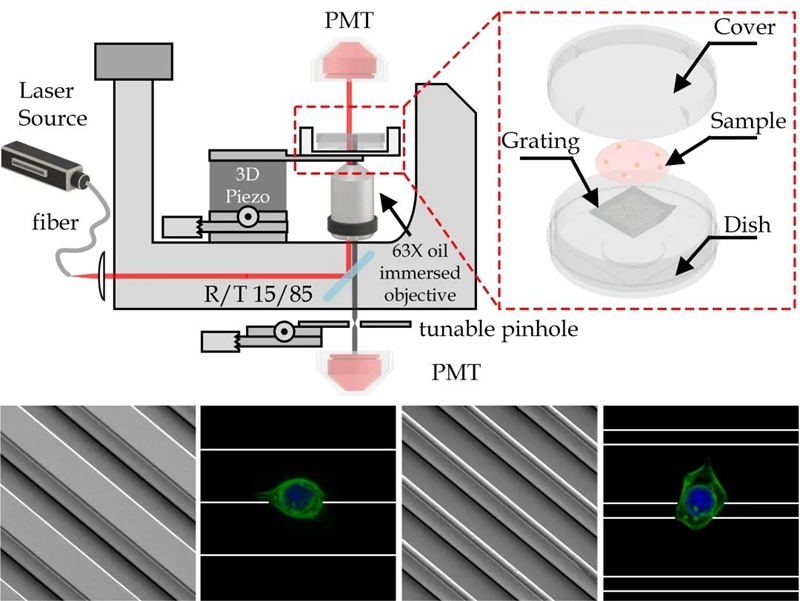
图1. 微格栅结构的扫描电镜图像以及不同细胞-基底接触模式下的共聚焦显微镜活细胞荧光图。
在这项工作中,作者利用深离子反应刻蚀和软光刻技术制备出在体外模拟翼状肌肌管的微米结构。并在此结构上探索良性鼻咽上皮细胞和鼻咽癌细胞的铺展和迁移特性。
作者设定18微米和5微米的格栅宽度以分别在体外模拟正常肌管直径和隐性肌管直径。在本文的数据分析中,作者只选择了18微米格栅宽度的单边缘接触的细胞和5微米格栅宽度的双边缘接触的细胞,并将这些细胞接触基底方式命名为“单边缘”和“双边缘”接触模式。

图2. 通过IRM的干涉反射通道(IRC)和透射通道(TC)观测NP460细胞分别在5分钟和60分钟时的双边缘接触,单边缘接触和无边缘接触模式下的显微镜图像。
作者利用干涉反射显微镜(IRM)来观测细胞与基底之间的粘附动态过程。使用带有活细胞观测套件的显微镜观测细胞迁移动态过程及捕捉迁移过程中的细胞形态。同时也报道了在微米拓扑结构下的细胞铺展和迁移行为的相关性,此相关性为深入了解鼻咽肿瘤转移机制提供更准确的预测。
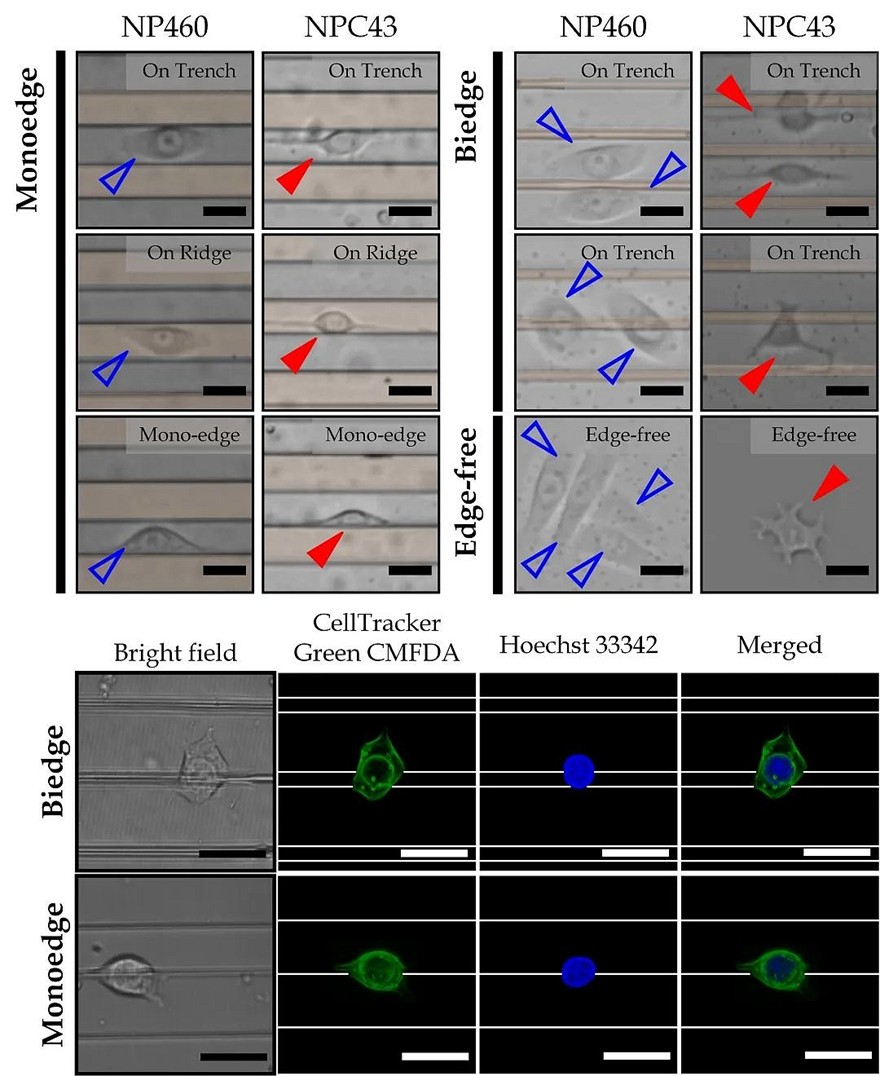
图3. NPC43细胞以及NP460细胞在微格栅结构上迁移过程中的细胞形态显微镜图以及共聚焦显微镜活细胞荧光图。
作者利用IRM所观测到的细胞铺展动态过程结合在正置光学显微镜下观测到的细胞迁移轨迹,迁移速度和方向建立联系。结果表明,在不接触格栅边缘的情况下,细胞迁移速度与细胞铺展特性(面积和铺展速度)的相关性非常弱(|r| < 0.14)。然而,在与格栅边缘接触模式下的细胞迁移速度与铺展面积和铺展速度之间存在一定的相关性(−0.71 < r <−0.34)。具体来说,18微米宽度下的微格栅结构可以引导所选细胞的迁移方向。在一定程度上可以解释鼻咽癌倾向于向邻近的翼状肌扩散的现象。此外,翼状肌肌管的平均直径约为18 微米。微格栅结构上的细胞铺展和迁移研究可以进一步应用于肌肉组织工程和更广泛的细胞研究领域。
本研究的相关结果作为(内页)封面文章已发表于ACS Applied Bio Materials, Volume 4, Issue 4。香港城市大学生物医学工程系博士研究生柳毅和首都医科大学生物医学工程学院任冀峰博士为文章共同第一作者,香港城市大学生物医学工程系林晓维副教授和香港城市大学电机工程系彭慧芝教授为本文的共同通讯作者。本项目得到了国家自然科学基金委员会(NSFC Grant 31770920)和香港研究资助局(General Research Grant 11216220 and Collaborative Research Fund C1013-15GF)的支持。
扫描二维码阅读英文原文,或点此查看原文

ACS Applied Bio Materials, 2021, 4, 4, 3224–3231
Publication Date: February 19, 2021
https://pubs.acs.org/doi/10.1021/acsabm.0c01610
Copyright © 2021 American Chemical Society

ACS Applied Bio Materials 创刊于2018年7月,仅在线出版,12期/年,已被 Web of Science (Emerging Sources Citation Index),Scopus 等数据库收录,旨在为读者及作者提供生物相关功能材料的设计及其应用的突破性与原创性研究,是将材料学、工程学、生物学、医学及化学知识融合于重要的生物应用的前沿期刊。
涵盖研究领域包括生物材料、生物医用材料、生物能源、生物催化、生物电子、生物污损与防污材料、仿生材料、生物分子成像/传感、药物传递/靶向、自修复材料、抗菌/抗微生物及抗癌生物材料等。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
Dihydromyricetin inhibits cancer cell migration and matrix metalloproteinases-2 expression in human nasopharyngeal carcinoma through extracellular signal-regulated kinase signaling pathwayCheng-Chen Huang, Chun-Wen Su, Po-Hui Wang, Yen-Ting Lu, Yu-Ting Ho, Shun-Fa Yang, Chung-Han Hsin, Chiao-Wen Lin
-
CD9 Upregulation-Decreased CCL21 Secretion in Mesenchymal Stem Cells Reduces Cancer Cell Migration.International Journal of Molecular Sciences (IF 4.9) Pub Date : 2021-02-09 ,DOI:10.3390/ijms22041738Chia-Chu Hsieh,Szu-Chun Hsu,Ming Yao,Dong-Ming Huang


































 京公网安备 11010802027423号
京公网安备 11010802027423号