“能”尽其性,与有“溶”焉:Science报道ATP不仅供能,还可增溶
腺嘌呤核苷三磷酸简称三磷酸腺苷(ATP),是生物体内最直接的能量来源。它由一分子腺嘌呤、一分子核糖以及三分子磷酸基团组成,分子简式表示为A-P~P~P。作为一种不稳定的高能化合物,它含有两个高能磷酸键。通常情况下,ATP在水解酶的作用下可以使距离腺苷最远的高能磷酸键发生断裂,生成二磷酸腺苷(ADP)与游离磷酸基团的同时释放出30.54 kJ/mol的能量。绝大多数生物可以通过呼吸作用释放的能量合成ATP,除此之外,绿色植物还能利用光合作用的光反应阶段吸收光能用于该化合物的合成。ATP与ADP的相互转化实现了贮能与放能的循环过程,从而确保生物体内各项生命活动的能量供应与正常运转。
早期的研究发现,细胞质内的ATP仅需达到微摩尔级浓度便可以维持生物体内新陈代谢的顺利进行,但其实际浓度却可以达到约5 mM。细胞在新陈代谢过程中缘何投入远高于实际需求的能量来合成过剩的ATP,一直是个未解之谜。一个可能的解释是为了促使细胞内ATP供能的多种酶促反应自发进行,细胞质内ATP的浓度需要比ADP的高约50倍。另外,细胞质内含有复杂多样的蛋白质,其浓度超过100 mg/mL,在体外维持这样高浓度的蛋白质且不发生聚集是十分困难的,通常需加入一定量的水溶助剂(hydrotrope)促进蛋白质的分散与溶解。而在体内无外加水溶助剂的情况下,蛋白质如何在细胞质内形成良好的分散体系便引发人们的思考。
最近,德国马克思-普朗克分子细胞生物学与遗传学研究所的Anthony A. Hyman教授与美国芝加哥大学的Yamuna Krishnan教授合作对这一问题进行了深入的探究。他们猜测ATP可以起到水溶助剂的作用使细胞质内蛋白质溶解。实验过程中发现,ATP可以阻止已经形成淀粉样蛋白块的蛋白质继续聚集,还可以促使已经聚集的蛋白质纤维发生溶解,为细胞内维持高浓度的ATP提出了另一个合理的解释。相关成果发表在Science 上。
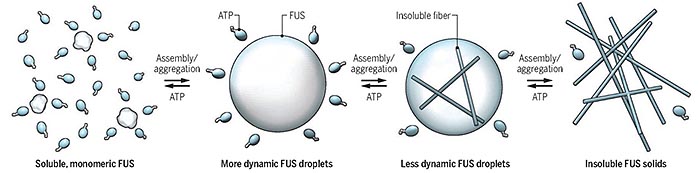
图1. ATP作为水溶助剂促进蛋白质溶解。图片来源:Science
水溶助剂在工业与药物研发领域已经使用数十年之久,用来解决部分有机物或聚合物在水溶液中溶解度差的问题。它通常由疏水的有机部分与亲水的离子部分组合形成两亲体。由于水溶助剂缺乏较长的疏水链,它不会像表面活性剂那样形成组织结构更大的胶束,在体系中形成两相隔离室。研究表明,水溶助剂利用其疏水区域与溶质的相应部分发生作用,从而降低溶质的表面张力。
ATP同时具有不溶于水的芳香环体系与易溶于水的三聚磷酸盐离子部分,符合水溶助剂的特征。于是作者设计了不同实验考察ATP对不同蛋白质的增溶特性。他们首先测试ATP对纯化的肉瘤融合蛋白(FUS)形成的相分离液滴带来的影响,利用ATP与Mg2+组成的复合物,以不同生理范围内的浓度作用于在体外构建的FUS相分离液滴。实验表明当ATP-Mg复合物的浓度达到8 mM时,该液滴发生溶解。与此同时,该浓度条件下的ATP-Mg复合物对其他蛋白质形成的相分离液滴具有同样的增溶效果。作者通过荧光示踪分子实验观察到溶解过程中ATP在相分离的液滴内大量富集,而使用无供能作用的APPNP与Mg2+复合也可以促进液滴溶解,由此说明在毫摩尔浓度下,ATP发挥增溶特性与其供能过程无必然联系。
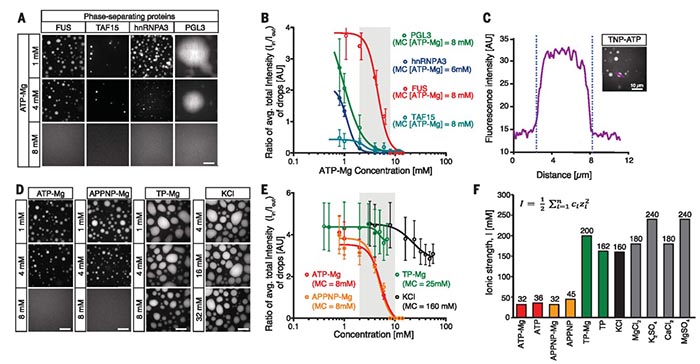
图2. ATP对非结构蛋白的溶解作用。图片来源:Science
他们还考察了生物体内其他生理及结构相关的磷酸苷是否会对FUS相分离液滴造成影响,GTP(三磷酸鸟苷)、ADP和AMP(单磷酸腺苷)都能有效溶解液滴。但由于这些磷酸苷在细胞内的含量较低,相比于ATP的作用可忽略不计,由此说明细胞内发挥蛋白质增溶作用的物质主要是ATP。使用无腺苷修饰的TP-Mg复合物却对该液滴无明显的影响。ATP腺苷部分的芳香基团可以在不溶于水的溶质分子周围形成动态簇,增强了三聚磷酸盐部分的电荷对蛋白质稳定性的影响,再次证实了ATP的疏水有机部分与亲水离子部分对促进蛋白质溶解共同发挥着重要作用。对比工业上常用的水溶助剂二甲苯磺酸钠(NaXS)或单甲苯磺酸钠(NaTO),ATP具有更强的增溶性。
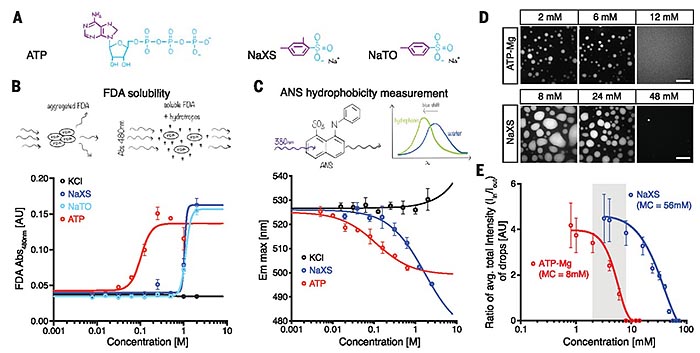
图3. ATP水溶助剂特性的探究。图片来源:Science
接下来他们设计了离心实验,发现毫摩尔浓度的ATP仅可以溶解FUS纤维,而随着其浓度增加,ATP在促进蛋白质溶解的同时还可以发挥阻聚作用。在硫磺素T的协同作用下,作者发现ATP可有效防止易形成淀粉样蛋白的两种蛋白质发生聚集,一种是与阿尔茨海默氏病有关的β淀粉样蛋白Aβ42肽,另一种是朊病毒结构域的酵母蛋白Mot3(Mot3-PrD),通常认为引发这两种病症的原因与相应的蛋白聚集有关,ATP的有效阻聚对开展相关疾病的治疗具有很好的启发作用。除此之外,作者还设计了鸡蛋清中蛋白质的聚集实验。蛋清蛋白在高温下会破坏其天然构象,从而暴露出隐藏在蛋白质内部的疏水斑块,促使蛋清蛋白发生聚集。而在10 mM浓度ATP的条件下,蛋清蛋白加热至60 ℃,30分钟内无明显聚集现象。以上实验均说明了ATP对蛋白质具有显著的阻聚作用。
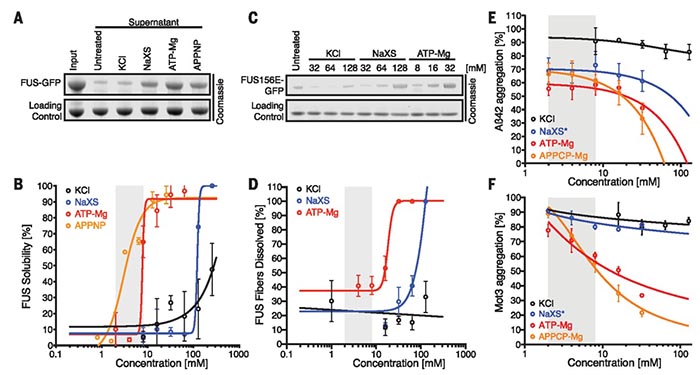
图4. ATP对蛋白质的阻聚作用。图片来源:Science
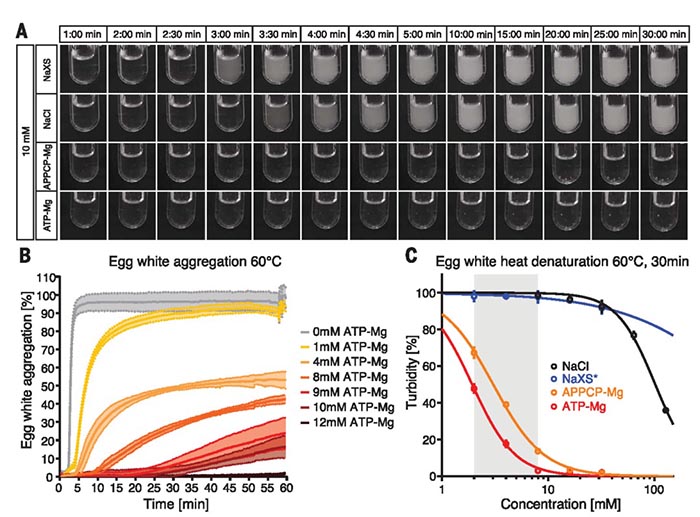
图5. ATP对蛋清蛋白的稳定作用。图片来源:Science
——总结——
在微摩尔级浓度下,ATP可以作为驱动生物体内新陈代谢的能量来源,而达到毫摩尔级浓度,它又起到了对细胞质内疏水蛋白质的增溶作用。美国德克萨斯大学西南医学中心的Allyson M. Rice和Michael K. Rosen提道:ATP的这种性质对不同功能蛋白发挥正常的生理活性,阻止其发生病态聚集具有至关重要的影响。追溯生命的起源,复杂的生物大分子一经产生便有可能面临聚集问题,而ATP很可能在生命进化的早期对生物大分子阻聚起到了不可忽视的作用。另一方面,随着年龄增长而导致线粒体损伤,体内ATP水平下降,与细胞内蛋白聚集相关的疾病与老化随之产生。如果可以使体内ATP恢复正常水平,或许将为衰老相关的健康问题带来行之有效的解决方案。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

ATP as a biological hydrotrope
Science, 2017, 356, 753, DOI: 10.1126/science.aaf6846
部分内容编译自:
http://science.sciencemag.org/content/356/6339/701
http://cen.acs.org/articles/95/i21/New-role-cells-suggested-ATP.html
(本文由夜若岚尘供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号