肿瘤微环境激活型近红外II区荧光纳米诊疗系统用于腹膜转移瘤的精准诊疗
恶性肿瘤是目前人类生命健康的重大威胁。基于诊疗一体化理念,新兴发展的纳米诊疗系统将诊断和治疗功能有机结合,相对于单一的诊断或治疗手段具有明显优势。然而,目前大多数报道的纳米诊疗系统,无论是检测信号和治疗药物都始终处于“always-on”模式,导致了高的背景信号,极大降低了检测的灵敏度,同时药物递送过程中的脱靶和降解问题会对正常组织造成严重毒副作用。因此,设计具有协同诊断和治疗双功能的“激活型”诊疗系统具有非常重要的临床意义。
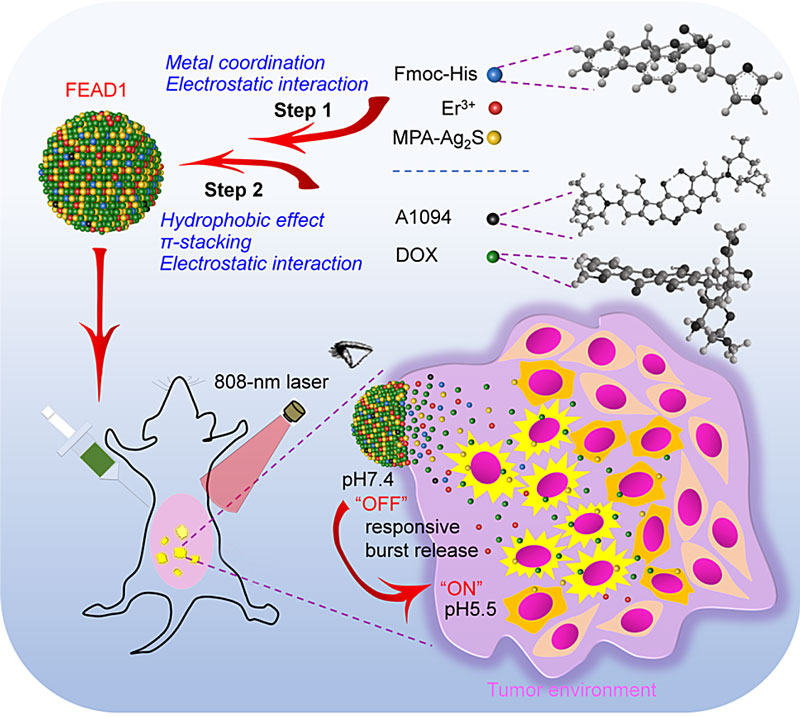
中国科学院苏州纳米技术与纳米仿生研究所王强斌(点击查看介绍)团队一直致力于近红外II区荧光“可视化”精准医学创新研究。在最近的研究中,他们基于高组织穿透深度、高时空分辨率的近红外II区荧光影像技术,发展了Ag2S量子点-多肽自组装体系,有效放大检测目标的荧光信号,实现0.2 mm直径大小肿瘤转移灶的精准手术清扫 (Angew. Chem. Int. Ed., 2019, 58, 11001-11006);同时针对“always-on”荧光探针面临的低检测特异性和灵敏度问题,构建了靶标分子选择性响应的“激活型”近红外II区荧光探针,实现对脑机械损伤的精准诊断 (Angew. Chem. Int. Ed., 2020, 59, 247-252.)。在上述工作基础上,该团队最近基于多组分协同自组装策略,针对肿瘤组织特异性微酸环境,发展了一种新型“激活型”近红外II荧光纳米诊疗系统(FEAD1),实现了对腹膜转移瘤的精确诊断和治疗。该探针首先通过金属配位和静电作用使Er3+与Fmoc-His中组氨酸的咪唑基团和MPA-Ag2S量子点的羧基交联,进一步通过疏水相互作用、π-π堆积和静电力将化疗药物阿霉素(DOX)和近红外吸收染料A1094进行组装,成功构建了FEAD1。在正常组织中,由于A1094与Ag2S量子点之间的FRET效应,FEAD1呈现近红外II区荧光“Off”状态,同时化疗药物DOX被完整包裹在FEAD1中不释放;一旦FEAD1进入肿瘤组织,微酸环境引起Fmoc-His上咪唑基团及DOX质子化,弱化了金属配位效应及疏水作用力,触发FEAD1快速解聚,在肿瘤组织特异性激活荧光信号由“Off”到“On”以及药物分子快速、特异性释放。该激活型策略实现实时、原位、高灵敏检测肿瘤的同时能达到高效杀伤肿瘤的效果,显著提高存活率,为临床荧光指导的腹膜转移瘤检测和治疗评估提供了新思路。
相关工作于近期发表在Angew. Chem. Int. Ed.上。该工作得到了国家自然科学基金重点项目、中国科学院基础前沿科学研究计划从0到1原始创新项目和科技部重点研发计划的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Tumor Microenvironment-Activated NIR-II Nanotheranostic System for Precise Diagnosis and Treatment of Peritoneal Metastasis
Sisi Ling, Xiaohu Yang, Chunyan Li, Yejun Zhang, Hongchao Yang, Guangcun Chen, Qiangbin Wang
Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.202000947
导师介绍
王强斌
https://www.x-mol.com/university/faculty/23252
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






















































 京公网安备 11010802027423号
京公网安备 11010802027423号