在介绍张绪穆教授课题组的研究内容之前,笔者首先简要概括一下他的教育背景。张绪穆教授1961年10月出生于湖北省鄂州市,1982年在武汉大学获得学士学位;1985年在中国科学院福建物质结构研究所获得硕士学位,师从卢嘉锡院士;1987年在加州大学圣地亚哥分校(University of California, San Diego)获得硕士学位,师从Gerhard N. Schauzer教授;1992年在斯坦福大学(Stanford University)获得博士学位,师从美国国家科学院院士James P. Collman教授;1992—1994年在斯坦福大学做博士后研究;1994—2006年任教于美国宾夕法尼亚州州立大学并获终身教授职位;2007—2015年任新泽西州立大学化学学院杰出讲席教授;2015—2018年,任南方科技大学化学系讲座教授及系主任;2018年—现在,任南方科技大学理学院副院长;2019年—现在,任南方科技大学生物医药研究院院长;2020年—现在,任南方科技大学坪山生物医药研究院院长。
张绪穆教授在Science, Nat. Chem., J. Am. Chem. Soc., Angew. Chem.等学术刊物上发表学术论著400余篇,论文他引>15000多次, 其中单篇论文他引>1700次,H index 72,连续多年入选全球知名出版商Elsevier发布的高被引科学家,入选美国斯坦福大学发布的2020年“全球前2%顶尖科学家”榜单。张绪穆教授2002年获得美国化学会Cope Scholar 奖,是第一位荣获此奖的中国内地出生的科学家。张绪穆教授发展的张烯炔环异构化反应(Zhang enyne cycloisomerization)因其重要性成为以其姓氏命名的人名反应,目前全球仅有少数几位华人有此殊荣。因促成建立中国内地首个以诺贝尔奖得主命名的研究机构—深圳格拉布斯研究院,张绪穆教授获得2016年深圳首届“时代深士”称号。
张绪穆教授长期致力于发展高效、高选择性不对称催化反应,利用自己原创的手性配体工具箱为技术平台,以重大药物合成为产业化突破口,开发有自主知识产权、安全、环保、低成本、高质量的药物绿色合成新工艺。张绪穆教授先后成立了凯瑞斯德(苏州)(Chiral Quest,技术产品)和凯特立斯公司(Catalys,技术平台)。凯瑞斯德成立于2008年,已有20多个年产大于5吨的新工艺路线投入生产,每年生产几百吨医药中间体和原料药,影响全世界数亿患者的用药需求。凯特立斯(深圳)科技有限公司成立于2015年,2018年正式启动项目研发,已取得依折麦布、孟鲁斯特、苯福林、沙库必曲等10多种大品种药物新工艺路线的重大突破。
张绪穆教授在不对称氢化和手性膦配体研究领域已经有二十多年的研究经历,并且取得了丰硕的研究成果。张绪穆教授是全球磷化学领域的权威专家,曾经连续两次受邀在第16届和17届国际磷化学会议上做大会报告(2004年在英国伯明翰;2007年在中国厦门)。张绪穆教授开发的手性工具箱广泛应用于不对称氢化、不对称氢甲酰化反应等领域,在不对称催化领域具有广泛的国际影响力,其中DuanPhos、Binapine、TangPhos、TunePhos等配体在国际上应用较为广泛。
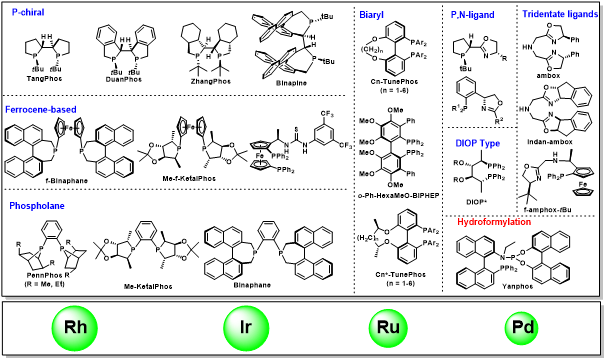
图1 张绪穆团队开发的手性工具箱
1. 刚性、富电子手性双膦配体的开发与应用
张绪穆教授在手性配体的合成和应用方面做出了许多开创性的工作,发展了系列刚性、富电子的三烷基双膦配体,如TangPhos、DuanPhos、Binapine等应用于铑金属的不对称氢化。该类富电子膦配体能够加速一价Rh对氢气的氧化加成,提高反应性(图1.2)。同时,强的反位效应可以减少产物抑制,提高转化数。由于配体的刚性,能给出很好的立体选择性。以上几种特性,使得该类配体成为铑金属不对称氢化中的超实用配体,广泛应用于凯瑞斯德生化(苏州)有限公司工业化生产,其中多个配体的金属络合物已经成为商业可得的高效金属催化剂,可以从试剂公司Strem或Aldrich购买得到(图1.3)(Acc. Chem. Res. 2020, 53, 1905–1921; Acc. Chem. Res. 2007, 40, 1278-1290; Chem. Rev. 2003, 103, 3029-3069;Chin. J. Chem. 2020, 38, 954-968)。

图1.1 TangPhos的结构与手性诱导模型

图1.2 张绪穆团队开发的代表性刚性、富电子双膦配体

图1.3 张绪穆团队开发的商业可得的手性催化剂
2. 基于二茂铁骨架的超高效手性多齿配体的开发与应用
上个世纪90年代,张绪穆教授在国际上率先将手性三齿配体应用于简单酮不对称(转移)氢化。1998年,首次发展的三齿配体ambox在不对称转移氢化、不对称转移氢化中表现出优异的对映选择性控制。从2016年开始,以廉价的Ugi胺为手性原料,陆续发展了f-amphox、f-amphol、f-ampha、f-amphamide等一系列容易合成、结构可调的二茂铁骨架手性三齿配体,在羰基化合物的不对称氢化中表现超高的催化效率(TON:1,000,000)和对映选择性(>99% ee),含膦大位阻二茂铁骨架的引入不仅提高了配体的活性和选择性,也使得配体更加稳定和更加容易修饰。

图2.1 手性三齿配体ambox的设计模型

图2.2 三齿配体设计理念以及ambox和f-amphox的催化效率对比
和Noyori的催化体系相比,张绪穆团队发展的三齿配体具有以下特点:(1) 形成的铱催化剂异常稳定;(2) 具有超高的反应活性;(3) 配位饱和有效地阻止了产物的抑制作用。此外,三齿配体对碱的容忍性更好,具有更高的催化效率,更广的底物适用范围。

图2.3 张绪穆课题组发展的一系列基于二茂铁的三齿配体及其应用
基于二茂铁骨架的手性三齿配体在铱催化酮的不对称氢化中展示出了超高的催化效率和非常宽的底物普适性(图2.3)。目前,手性三齿配体f-phamidol已经实现了公斤级规模的生产,并被成功应用于依折麦布、苯福林、孟鲁司特等多种重大药物关键中间体的高效合成中。
3. 基于“非共价键相互作用”策略发展新型的手性双膦配体
过渡金属催化的不对称反应的发展高度依赖于手性配体的发展,为了进一步提高不对称催化反应的对映选择性和反应活性,发展更为高效、更为实用同时易于合成和对空气稳定的手性膦配体具有重要意义。非共价键相互作用在催化剂的设计中扮演着重要的角色,能够稳定反应的过渡态,减少过渡态中的自由度,降低反应的活化能。代表性的非共价键相互作用有空间排斥作用、氢键和离子对相互作用,其中氢键和离子对相互作用较强。基于“非共价键相互作用”策略,张绪穆研究团队将氢键和离子对相互作用引入到手性双膦配体中,发展新型高效的手性双膦配体,2020年,张绪穆团队在Acc. Chem. Res.上对该部分工作进行详细的介绍 (Acc. Chem. Res. 2020, 53, 1905-1921)。
3.1基于“氢键相互作用”策略,发展了双功能有机-金属催化手性双膦-(硫)脲配体。
在过去的几十年里,金属催化和有机催化取得了巨大的成功,但仍存在很多仅使用有机催化或金属催化难以实现的反应。将有机催化和金属催化联合起来解决单一催化剂面临的难题是热门研究领域之一。有机与金属双催化模式间往往存在催化剂、底物、中间体等不兼容问题。因而,非常有必要发展新的不对称催化策略,将有机催化和金属催化结合到同一分子中,发展双功能的新型有机-金属催化剂,一方面运用有机催化单元对底物进行活化和手性诱导,另一方面通过金属催化单元对底物进行多重活化,高效地实现一些仅用有机催化或金属催化难以催化的反应,为实现挑战性的新反应提供了有力途径。
基于此,运用“氢键相互作用”策略发展有机-金属双功能新型双膦-硫脲配体ZhaoPhos (图 3.1),该配体中含有金属催化中手性双膦配体骨架和有机催化中的硫脲骨架,拥有多个优点:合成原料便宜易得、双功能活化作用、结构易于修饰、对空气稳定、能大规模合成。

图 3.1 基于有机-金属催化策略发展双功能的手性双膦-硫脲ZhaoPhos配体
基于“氢键相互作用”策略发展的双功能手性双膦-硫脲ZhaoPhos配体性能优异,张绪穆研究团队运用该配体的硫脲骨架为氢键给体,与底物上为氢键受体的硝基、酰胺等基团作用形成氢键,起到活化底物和良好的手性诱导作用,高效地实现了铑催化的一系列不对称氢化反应(超过20类)。张绪穆研究团队成功地发展了首例基于过渡金属-双膦配体催化和硫脲基团氢键相互作用的马来酰亚胺的不对称氢化反应,在温和的条件下,多种3-取代马来酰亚胺可以实现高产率和高ee值的不对称氢化,同时反应活性在硫脲基团的活化下也大大提高,TON最高可以达到2 000(图 3.1)。核磁滴定实验及控制实验验证了配体和底物羰基之间的氢键相互作用。该研究成果发表后(ACS Catal., 2016, 6, 6214),国际著名评述杂志Synfacts (2016,12,1170)对该研究工作进行了亮点介绍。
此外,张绪穆研究团队成功地将“氢键相互作用”策略应用到β-硝基烯酰胺的不对称氢化,ZhaoPhos上的硫脲骨架与底物上的硝基形成氢键来活化底物,进而提高反应的活性和立体选择性,而且易被还原的硝基得到了保留,构建了一系列高光学活性手性β-硝基胺类化合物(up to 96% ee,96% yield),该研究成果发表后(Org. Lett., 2016, 18, 40),国际著名评述杂志Synfacts (2016, 12, 378)对该研究工作进行了亮点介绍。
图 3.2 功能有机-金属催化手性双膦-(硫)脲配体Zhaophos的应用
3.2 基于“非共价键离子对相互作用”策略发展新型的手性双膦配体
通过在手性配体中增加次级作用基团来增强配体与底物间的相互作用,选择性地稳定反应过渡态中的某一种非对映异构过渡态,提升催化剂的手性控制能力和反应的活性。基于非共价键离子对次级作用活化策略,张绪穆研究团队设计与合成了含次级基团的新型二茂铁手性双膦配体(图 3.3),以便宜易得的手性Ugi’s胺为起始原料,在二茂铁骨架上引入手性膦基团,该配体上的氨基-NMe2能与底物形成非共价键离子对次级相互作用,起到活化底物和提高反应立体选择性的作用。该类配体拥有面手性和中心手性,非手性膦上的位阻大的基团和二茂铁骨架占据了三个象限,手性膦上的位阻小的取代基使第四象限处于开放状态,提供了良好的手性诱导环境。

图 3.3 含次级基团的新型双膦配体及其象限结构
张绪穆团队运用含次级基团的二茂铁手性双膦配体实现了Rh催化的2-取代丙烯酸的不对称氢化反应,配体的次级基团-NMe2与底物上的羧基形成非共价键离子对相互作用,反应条件温和、不需要额外的加碱,取得了高达99% ee和>99%的转化率,TON高达20,000(图 3.4)。基于产物的构型和配体的单晶结构,建立了3D反应过渡态模型,发现底物上的苯基占据开放状态的第四象限,与催化剂间存在较小的排斥作用,且有利于形成非共价键离子对次级相互作用,从而获得了(S)构型的羧酸产物。该模型进一步说明了催化剂与底物间的非共价键离子对次级相互作用和配体的三个象限被占据有利于提供良好的手性诱导效果。该工作发表在Chem. Sci., 2016, 7, 6669) 后受到国际同行的广泛关注,并被在国际期刊Synfacts上(2016, 12, 931)正面评价。

图 3.4 2-取代丙烯酸类化合物的不对称氢化反应
手性胺结构广泛存在于天然产物和药物分子中。特别是最近20年开发出的新药中,手性胺得到了越来越多的应用(图 4.1)。不仅如此,在新型手性药物、农药以及日化品的设计、合成和开发中,手性胺骨架也是考察和使用最多的类型之一。此外,手性胺在有机合成特别是手性胺配体合成以及作为有机小分子催化剂等领域应用也十分广泛。由于其重要性,开发高效、高选择性和经济性的策略构建手性胺吸引了化学家们极大的关注。

图 4.1 包含手性胺结构的代表性药物分子
2018年,张绪穆课题组利用无机氨盐为胺源,钌的C3*-TunePhos络合物为催化剂,氢气为还原剂,实现了简单芳基酮的不对称还原胺化,通过该方法可以高效合成得到手性伯胺产物(图 4.2)。该反应具有非常重要的应用价值,目前已被成功应用于重大药物西那卡塞关键中间体的不对称合成当中 (J. Am. Chem. Soc. 2018, 140, 2024-2027),该研究工作被Synfacts进行亮点评述(Synfacts 2018, 14, 0504)。

图 4.2 钌催化烷基芳基酮不对称转移氢化合成伯胺
同年,张绪穆课题组也实现了环状β-酮酰胺的动态动力学拆分不对称还原胺化,能够以高达98%的收率99%的ee值合成得到手性伯胺产物,该产物经过简单的转化就可以合成得到许多药物的关键中间体(图 4.3),具有非常好的实用价值(Angew. Chem., Int. Ed. 2018, 57, 14193-14197)。

图 4.3 钌催化β-酮酰胺的动态动力学拆分不对称还原胺化
5. 手性氧杂螺环配体的设计、合成与应用
由于其结构上的刚性和稳定性,螺环配体越来越得到有机合成化学家的重视。特别是南开大学周其林课题组的研究工作,更是将螺环配体的发展推向了高潮,使手性螺环配体在短短的数十年间发展成为一类应用广泛的优势结构配体。周其林小组最具代表性的手性配体是SpiroPAP, 该配体的铱的络合物在简单酮的不对称氢化中可以获得高达99.9%的对映选择性和4,550,000 的TON,创造了不对称氢化领域TON的最高纪录(Angew. Chem., Int. Ed. 2011, 50, 7329-7332)。
但是螺环配体也存在骨架结构单一等缺点。为了克服上述难题,2018年,张绪穆课题组以分子内的双重芳香亲核取代为关键步骤高效合成得到了一种新型氧杂螺环二酚骨架O-SPINOL,并以O-SPINOL为起始原料合成得到了O-SpiroPAP配体,该配体在Bringmann内酯的动态动力学拆分不对称还原中表现出优异的反应活性和对映选择性(图 5.1) (J. Am. Chem. Soc. 2018, 140, 8064-8068),该研究工作被Synfacts进行了亮点评(Synfacts 2018, 14, 1050)。

图 5.1 氧杂螺环配体的合成与在Bringmann内酯还原中的应用。
此外,基于O-SPINOL骨架的氧杂螺环双膦配体O-SDP在α,β-不饱和羧酸的不对称氢化中表现出优异的反应活性和选择性。此外该配体的钌的络合物可以用于重大药物沙库必曲的不对称合成中,具有非常重要的应用价值 (图 5.2) (CCS Chemistry 2020, 2, 468-477)。

图 5.2 氧杂螺环配体O-SDP在不饱和羧酸不对称氢化中的应用
6. 铑催化的不对称烯炔环异构化反应 (张烯炔环异构化反应)
过渡金属催化的烯炔环异构化反应是构建环状化合物非常高效的方法,早在2000年,张绪穆课题组研究发现1,6-烯炔底物在铑-双膦配体催化剂的作用下可以以非常高的区域选择性得到五元杂环或者碳环化合物,该反应是首例铑催化的1,6-烯炔环异构化反应(Angew. Chem., Int. Ed. 2000, 39, 4104-4106)。后续的研究发现采用BINAP作为手性配体就可以得到非常高的对映选择性,并且该反应具有非常广泛的底物适用范围,2016年,张绪穆团队成功将该反应的底物适用范围由顺式双键底物扩展到了更常见的反式双键底物。

图6.1 首例铑催化的1,6-烯炔的不对称环异构化反应

图6.2 张烯炔环异构化反应及其机理
2014年3月,张绪穆教授的研究成果“烯炔的环异构化反应”,被冠以“张”姓,命名为“Zhang enyne cycloisomerization”。该成果已被国际化学权威著作Name Reactions收录,成为以中国人名命名的为数不多的人名反应之一(图6.2)。
“张烯炔环异构化反应”有着广泛的适用性和实用性,利用该反应可以方便的实现烯烃和炔烃分子内的不对称环化,高效地构筑了一系列五元杂环化合物,在生物活性分子以及药物分子的合成中有重要的应用。例如,世界著名的有机化学家Nicolaou教授用张绪穆教授发展的人名反应实现了复杂活性分子平板霉素的全合成(J. Am. Chem. Soc. 2009, 131, 16905-16918)。张绪穆团队也采用该合成方法实现了Kainic acid的高效不对称合成(Chem. Commun. 2018, 54, 727-730)。

图6.3 前列腺素类化合物的高效合成
2021年,张绪穆团队在烯炔环异构化领域再次取得重要进展,以三齿配体铱络合物催化的烯酮不对称氢化和课题组发展的“烯炔环异构化”反应为关键步骤实现了系列前列腺素和相关药物的简洁、高效不对称全合成,将合成步骤缩短到了6步,极大地提高了合成效率,并且实现了20克规模合成氟前列醇(fluprostenol),相关研究成果发表在Nat. Chem.上(Nat. Chem. 2021, 13, 692-697)。前列腺素是一类具有广泛生物活性的激素类物质,具有非常好的成药性,目前,在世界范围内有超过20种前列腺素类上市药物。该研究成果极大地提高了前列腺素类化合物的合成效率,对前列腺素相关药物的研究具有重要意义(图6.3)。
7. 铑催化的不对称氢甲酰化反应
氢甲酰化反应是以烯烃和合成气为原料高效合成醛类化合物的重要反应. 由于醛类化合物在工业合成中有着极其重要的应用, 氢甲酰化反应被学术界和工业界广泛研究,并已发展成为当今工业上规模最大的均相催化反应之一。 据统计, 全球通过氢甲酰化生产醛、醇的能力已经达到千万吨规模。 相比较而言, 利用手性催化剂合成手性醛的不对称氢甲酰化反应的发展却比较缓慢, 目前还没有工业应用的报道。手性配体对于不对称氢甲酰化反应的活性、化学选择性和对映选择性都有显著影响,目前能够应用于不对称氢甲酰化反应的手性配体的种类非常有限,新型手性配体的开发是该领域最具挑战性的难题,在该领域中有将近一半的手性配体都是张绪穆研究团队开发的(图7.1)。

图7.1 应用于不对称氢甲酰化反应的手性配体
张绪穆教授开发的YanPhos是在不对称氢甲酰化反应中应用最为广泛的手性配体之一,在多种底物类型的不对称氢甲酰化反应中表现出优异的反应活性和对映选择性:(1) YanPhos在4-取代环戊烯类底物的去对称化不对称氢甲酰化反应中表现出优异的反应活性和対映选择性 (up to 96% yield, up to >99:1 dr, up to 97% ee; Angew. Chem. Int. Ed., 2016, 55, 6511-6514)。(2) YanPhos在1,2-二取代硅基烯烃的不对称氢甲酰化反应中表现出优异的区域选择性和对映选择性 (up to 98% yield, up to >99:1 dr and up to 97% ee; Nat. Commun. 2018, 9, 2045)。(3) YanPhos在挑战性底物1,1-二取代烯烃的不对称氢甲酰化反应中表现出优异的区域选择性和对映选择性 (J. Am. Chem. Soc, 2018, 140, 4977-4981)。

图7.2 YanPhos在环戊烯和硅基烯烃不对称氢甲酰化中的应用

图7.3 Rh/(S,S)-DTB-YanPhos催化非官能团化1,1-二取代烯烃不对称氢甲酰化

