聚多巴胺作为一种通用的分子粘合剂,受到了广泛的赞誉。它的灵感来自于贻贝粘附蛋白,能够有效地粘附各种材料表面。自2007年首次报道以来,聚多巴胺已成为跨学科研究的焦点,吸引了各个学科的研究人员。其独特的粘附性能和良好的生物相容性使其广泛应用于生物医学领域。
众所周知,多巴胺在体内作为神经递质和激素,参与行为和认知的过程,也会影响心脏和肾脏疾病等临床结果。然而,聚多巴胺,多巴胺衍生物,在体内的生物安全性的仍未得到足够关注和深入研究。
最近,我们的研究团队在《ACS Biomaterials Science & Engineering》发表了题为Activation of Dopamine Receptor D1 and Downstream Cellular Functions by Polydopamine的研究论文。该研究揭示了聚多巴胺与多巴胺受体D1 (DRD1)的激活以及相关的细胞功能。这一发现为我们深入理解多巴胺受体和聚多巴胺之间的相互作用提供了新的视角,为聚多巴胺材料在治疗环境中开辟了潜在的途径,有望为开发多巴胺相关疾病的治疗策略和生物医学材料提供新的启示。
在该课题中,我们面临了直接检测DRD1激活状态的挑战。因此,我们采用均相时间分辨荧光(HTRF)技术,通过检测第二信使cAMP的水平来间接评估DRD1是否被激活。当HTRF比值较低时,表示胞内cAMP富集,表明DRD1被激活;反之,若HTRF比值较高,则表示DRD1未被激活。
我们首先建立了过表达DRD1的HEK 293细胞模型。在细胞黏附稳定后,我们通过添加多巴胺及多巴胺其衍生物刺激细胞,并利用HTRF技术测量细胞内cAMP的水平,以评估DRD1的激活情况。我们主要研究了在材料表面改性领域应用广泛的多巴胺衍生物,如邻苯二酚、左旋多巴、3,4-二羟基苯丙酸、5,6-二羟基吲哚以及两种多酚类分子单宁酸(TA)和没食子儿茶素没食子酸酯(EGCG)。实验结果表明,左旋多巴胺和邻苯二酚均能激活DRD1;然而,其他分子分子不能激活DRD1(见图1)。这表明,DRD1的激活似乎需要具备游离胺基或分子空间位阻较小的特性。
由于聚多巴胺在生物医学领域具有广泛的应用,因此,我们研究了聚多巴胺和DRD1之间的相互作用,旨在深入探索其在生物医学应用中的潜在生物安全性。我们通过pH、UV和氧化剂诱导聚合等多种方法制备了聚多巴胺涂层,并合成了聚多巴胺纳米颗粒(见图2A-2B)。考虑到部分多巴胺单体以非共价形式参与涂层并持续释放,因此,我们严格清洗聚多巴胺涂层和纳米颗粒,确保释放的多巴胺浓度低于激活DRD1所需的最低浓度。实验结果表明,聚多巴胺纳米颗粒和以不同方式制备的涂层都可以激活DRD1(见图2C)。多巴胺的持续释放有可能是聚多巴胺激活DRD1的关键原因之一。随后,我们对未经充分清洗的聚多巴胺涂层进行检测发现同样能够激活DRD1。
尽管聚多巴胺的确切结构仍然是一个有争议的话题,但是无可争辩的是,涂层中含有游离的儿茶酚和胺基团,以及通过氢键和π-π堆叠相互作用稳定的单体排列,这些分子可能是激活DRD1的原因。为了进一步探究聚多巴胺激活DRD1的原因,我们模拟了聚多巴胺的氧化中间态——多巴醌与DRD1的相互作用,同时检测了聚多巴胺的多巴胺释放情况(详情见支持信息)。结果显示,氧化状态并不影响DRD1的激活(见图2C和图3D);此外,我们发现单宁酸-铁涂层(TA-Fe3+)没有激活DRD1,因为单宁酸已被证明对DRD1是惰性的(见图1E)。
为了进一步探索多巴胺衍生物,聚多巴胺与DRD1之间的相互作用机制,我们进行了分子对接模拟研究。通过建立各种配体与DRD1的分子对接模型,模拟了它们之间的结合构象和自由结合能。作为一个由七段跨膜螺旋(7TM)组成的跨膜受体蛋白,DRD1的残基D1033.32-S1985.42-S2025.46被认为是多巴胺结合和DRD1激活的关键位点。我们以多巴胺结合DRD1的构象为参考,跨膜螺旋5 (TM5)中的S1985.42和S2025.46侧链与儿茶酚结合,而跨膜螺旋3 (TM3)中的D1033.32侧链与配体的胺部分形成盐桥。根据分子对接实验结果(见图3),不同的配体以类似于多巴胺的结合模式分别以不同程度占据了正交配体结合口袋。邻苯二酚、左旋多巴和多巴醌在结合DRD1时与多巴胺类似的结合构象;而3,4-二羟基苯丙酸、和5,6-二羟基吲哚尽管能够进入DRD1的配体结合口袋,自由结合能较低,但不能诱导DRD1激活,因为其结合构象与多巴胺不同,并且失去了与TM5中的S1985.42和S2025.46的羟基之间的相互作用;我们还研究了生物惰性大分子修饰的4arm PEG-dopamine与DRD1的相互作用。实验结果显示,由于生物惰性大分子的修饰,它进入DRD1正交结合口袋的概率极大降低。因此,DRD1的激活仍然依赖于配体在特定结合位置的结合。这些结果不仅验证了实验发现,还为我们理解多巴胺衍生物,聚多巴胺与DRD1之间的相互作用机制提供了新的线索。
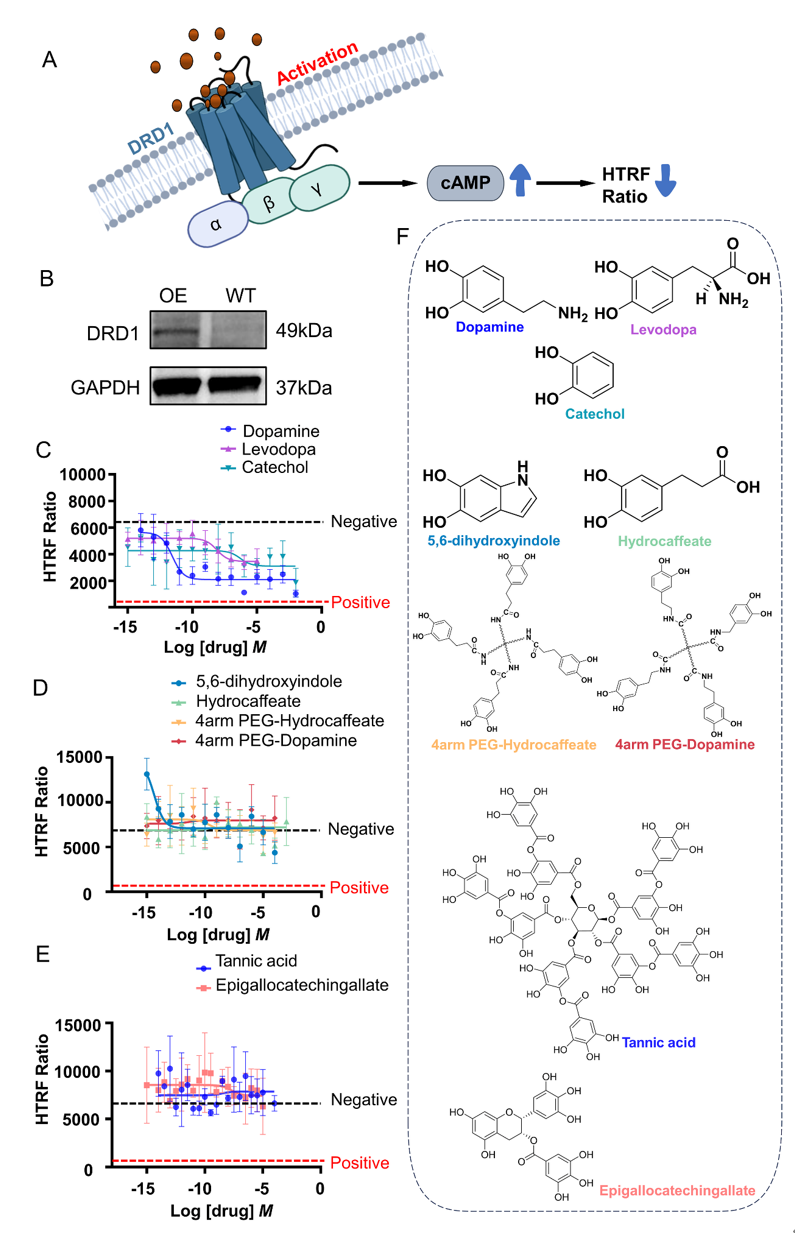
图1 多巴胺衍生物刺激下多巴胺受体D1 (DRD1)的激活

图2 聚多巴胺刺激下多巴胺受体D1 (DRD1)的激活

图3 多巴胺衍生物的分子对接
接下来,我们研究了聚多巴胺和多巴胺衍生物对细胞表型和功能的影响。我们主要关注cAMP/PKA信号通路和RhoA的激活,因为这两者在调节细胞的机械转导中起着关键作用。细胞对材料的粘附依赖于肌动球蛋白应力纤维产生的细胞牵引力。同时,肌球蛋白II磷酸化在cAMP下游的RhoA/ROCK信号通路介导的力的产生中起关键作用。为了实时监测细胞牵引力并将其转化为荧光信号的变化,我们首先引入了肌动蛋白张力传感器结合Förster共振能量传递(FRET)探针。FRET比率的增加表明肌动蛋白纤维内牵引力的减小。这种实时监测的能力使我们能够研究聚多巴胺和多巴对细胞力学转导的直接影响,进一步了解其对细胞表型和功能的调控。随后,我们将聚多巴胺纳米颗粒,多巴胺分别加入细胞或直接将细胞接种到聚多巴胺涂层上进行刺激。图4的实验结果证明,多巴胺和聚多巴胺处理细胞后,抑制了细胞力的机械传导。

图4 多巴胺和聚多巴胺处理对细胞机械转导的影响
我们进一步研究了RhoA下游的关键机械转导的关键蛋白,即非肌球蛋白II (myosin II)和层粘蛋白A/C (lamin A/C),以探究细胞对聚多巴胺的响应。与未处理的原始培养皿上的细胞相比,我们发现在聚多巴胺涂层中细胞的myosin II的磷酸化水平和lamin A/C的表达水平均有所降低(见图5A-5E)。此外,在聚多巴胺培养的细胞核中出现明显皱缩表明核张力降低,这些机械转导标志物的改变与观察到的细胞牵引力的变化一致。为进一步研究聚多巴胺影响细胞机械转导的信号通路,我们使用了蛋白激酶A(PKA)抑制剂H89。相比直接培养在聚多巴胺涂层的细胞,使用H-89处理培养在聚多巴胺涂层上的细胞后,其肌球蛋白II的磷酸化水平并没有受到聚多巴胺的影响(见图5F-5I),图5和图6展示了DRD1激活的下游信号通路。

图5 DRD1激活的下游信号
该研究揭示了聚多巴胺对多巴胺受体的激活和细胞黏附、信号转导的抑制,有助于深入理解聚多巴胺与多巴胺受体的作用机制,并为聚多巴胺相关领域的研究和应用提供了新的思路和方向。

图6 聚多巴胺激活后DRD1下游信号通路
论文详情请点击 https://doi.org/10.1021/acsbiomaterials.3c01615
文章的第一作者是硕士三年级学生孙欣,通讯作者是魏强研究员和邵振华研究员,特别感谢郭俊凌教授对本课题提供的支持与帮助。
魏强老师点评:
15年前,读硕士的时候,做聚醚砜膜表面改性,聚醚砜化学惰性,进展艰难。直到读到了Messersmith的polydopamine神文,打开了灌水的任通二脉,连发数篇文章。最快一篇,氧化诱导dopamine聚合,实验一周,写文章三天,投到Polymer Chemistry的第一期,引用700多次。
博士阶段继续灌水dopamine chemistry,一路灌上青千
但是逐渐产生疑惑,dopamine是体内激素,毒品就会刺激dopamine产生,造成依赖,polydopamine是否是安全的生物材料?
所有文章都会做细胞毒性,炎症反应等实验,显示positive结果,但dopamine本来就不应该有急性毒性。怎么表征,一直百思不得其解。
博士毕业,从0开始学习了近5年细胞生物学,逐渐系统性理解细胞受体与信号通路。
最关键是回国时候遇到了华西生物国重的dopamine GPCR受体专家邵振华老师,帮助我们建立了受体激活的表征体系。
我们发现polydopamine会直接激活1型多巴胺受体,此外聚合物中容易释放dopamine单体。激活的受体通过cAMP通路会改变一系列细胞行为。结果也和丁建东老师不久前发表的polydopamine实际上不利于细胞铺展的结论一致,我们从不同角度做出解释。
受体激活不会直接产生毒性,甚至可能药用,但是有毒品一样的风险。因此polydopamine基生物材料在转化过程中需要仔细评估长期安全性。
这个工作投稿很艰难,编辑都有兴趣,但审稿人那里阻力非常大,直到被ACS BSE接收。感谢编辑和审稿人能为这个工作开一面窗
最后祝贺这个工作的一作孙欣同学