近日,北京大学物理学院凝聚态所/前沿交叉学科研究院定量生物学中心/国科温州研究院罗春雄教授团队在《ANALYTICAL CHEMISTRY》期刊,发表文章“A 3D scalable chamber-array chip for digital LAMP”(DOI: 10.1021/acs.analchem.2c05288),该文章被选为期刊正封面论文进行推荐。

图1《ANALYTICAL CHEMISTRY》2023年5月23日上线的正封面图
数字PCR (dPCR)是一种核酸分子绝对定量技术,将样品中核酸分子随机分配到大量的反应单元,扩增结束后进行荧光信号采集得到阳性反应单元比例,根据泊松分布原理即可计算得到目标核酸分子的初始浓度。与目前主流的核酸定量技术荧光定量PCR(qPCR)相比,数字PCR无需标准品,并具有更高的灵敏度、更好的稳定性、更高的精确度,在重大疾病诊疗和精准分子诊断中具有巨大的应用潜力。随着反应单元总数的增加,数字PCR的灵敏度、精确度和动态范围等各项性能指标均会提高。
根据样品分配策略的不同,目前的数字PCR技术分为两大类,分别是基于液滴乳化的液滴数字PCR(droplet-based digital PCR, ddPCR) 和基于物理分隔的芯片数字PCR(chamber-based digital PCR, cdPCR)。ddPCR产生液滴的大小和数量是灵活的,因此很容易产生数以百万计的液滴,然而它有一些局限性,在PCR过程中,由于热运动或油的蒸发,一些液滴会合并,这会导致液滴体积的差异,使核酸分子分配概率产生差异,不符合泊松分布,对精度产生显著影响。此外,液滴dPCR还需要许多设施,包括液滴发生器、液滴传输系统和液滴计数系统,这增加了设备的初始成本,并需要持续消耗昂贵的材料。这些缺点阻碍了其在临床上的广泛应用。与ddPCR相比,基于物理分隔的cdPCR能够产生更均匀、更稳定的分区,其样品分配、检测工作流程也更简单,检测成本更低。然而,大多数先前开发的cdPCR方法需要用到微阀实现可靠的样品分配,反应单元总数受到可以可靠制造阀门的最大密度的限制。且极力的减小反应分区尺寸以二维扩展反应单元总数的方法:对芯片的制作要求更高;分区的体积小、蒸发面又大,蒸发问题更加严重,需要通过贴PVD膜、提前熏蒸和循环水流的操作防止蒸发,增加操作难度;通道截面太小流阻过大,样品加载与分配的时间也会加长。
另一方面,数字PCR需要相当复杂和准确的热循环控制,导致检测时间长、仪器成本高。一种有前景的替代方案是环介导的DNA扩增技术(Loop-mediated isothermal amplification, LAMP),这是一种简单、快速、特异、低成本的核酸等温扩增方法。LAMP技术的核心是由具有高链置换活性的DNA聚合酶Bst,以及两对引物进行的自动循环链置换DNA合成反应。扩增反应在65℃恒温条件下进行,可在15-60分钟内获得足够的扩增产物。由于其对仪器的低要求、快速和高特异性等优点,LAMP已被广泛用于临床诊断,特别是在护理点检测(POCT)领域。
在该研究工作中,作者开发了一种3D可扩展的腔室阵列芯片,该芯片通过堆叠微腔室阵列层来增加分区的数量,并采用数字LAMP技术来定量DNA分子。与二维扩展相比,该芯片可以在不增加芯片尺寸、操作工作流复杂性和操作时间的情况下,大大增加分区数量,以提高数字PCR的性能,结合环介导等温扩增技术,反应更迅速,且能够降低数字PCR系统的复杂程度,设计出更加便捷、低成本的仪器系统。该项工作将微阵列扩展至6层,单芯片可分隔近40万微反应单元。进样和分隔可以在三分钟内完成,整个反应可以在1h内完成。
芯片结构包括多层微阵列层和上层防蒸发的通水层。微阵列为256行,256列,单层反应单元数量为65536个。反应单元长宽高均为50微米,单个反应体积为0.125nL. 通道尺寸为20μm×15μm,连接主通道和微孔的微通道尺寸为7μm×15μm。通道两侧的阵列交错排列,以防止交叉污染。在该设计中,反应单元尺寸和阵列行列数可灵活修改,具有很好的灵活性和可扩展性。

为了测试3D dLAMP芯片的单分子扩增能力,作者使用浓度约为1000拷贝/μl(一个腔室中平均0.125拷贝)的人类β-肌动蛋白DNA分别在单层、三层和六层芯片中进行LAMP反应。结果表明,即使在位于芯片外围的腔室中也没有发生明显的反应液蒸发,各类芯片都能实现单分子扩增且无交叉污染,阴性阳性信号能明显分开。三层以下芯片能够使用普通荧光显微镜拍摄,仅需三分钟,进样和分区过程也可以在三分钟内完成,整个检测过程1h内即可完成。
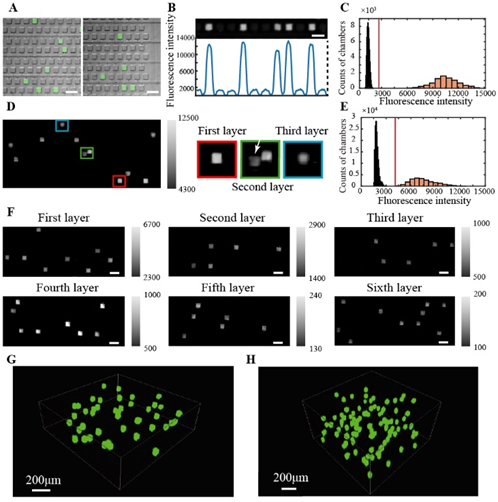
图3 芯片单分子扩增荧光图像
为了进一步测试芯片的动态范围、精确度、灵敏度等定量性能,作者使用了连续十倍稀释的β肌动蛋白DNA。DNA分子在芯片腔室中的随机分配符合泊松分布,因此,通过计数阳性分区数目利用泊松分布公式能够计算得到DNA模板数量。通过绘制预期和测量的DNA模板数量的对数,获得线性回归曲线,并与qPCR进行比较,结果表明,所有多层芯片中与预期的DNA模板数量非常匹配(图4A-C),qPCR方法只能得到Ct值,而不是精确的DNA数量或浓度(图4D)。dLAMP的测量数据和预期数据之间的线性关系优于qPCR。

图4. 单层、三层、六层芯片DNA分子定量性能测试
在各种核酸定量手段中,数字PCR或者数字LAMP作为单分子水平的绝对定量方法,提供了极高的准确性。与实时定量PCR相比,数字核酸定量的方法显然有潜力为诊断、预后和预测提供更灵敏、更可重复的临床方法。然而,其应用受到高成本和复杂操作的严重限制。在这项研究工作中,研究团队提出的3D可扩展芯片用于核酸绝对定量,它不仅具有更高的灵敏度和准确性,而且成本更低,操作更容易,在临床诊断中具有相当大的应用前景。
北京大学物理学院/定量生物学中心/国科大温州研究院罗春雄教授为本文的通讯作者,论文的第一作者为北京大学前沿交叉学院定量生物学中心博士生荣楠,参与工作的还有国科大温州研究院的博士后陈恺悦,北京大学的欧阳颀院士,博士生邵吉祺。上述研究工作得到了国家重点研发计划、国家自然科学基金、国科温州研究院重大项目的支持。
文章链接:
https://pubs.acs.org/doi/10.1021/acs.analchem.2c05288