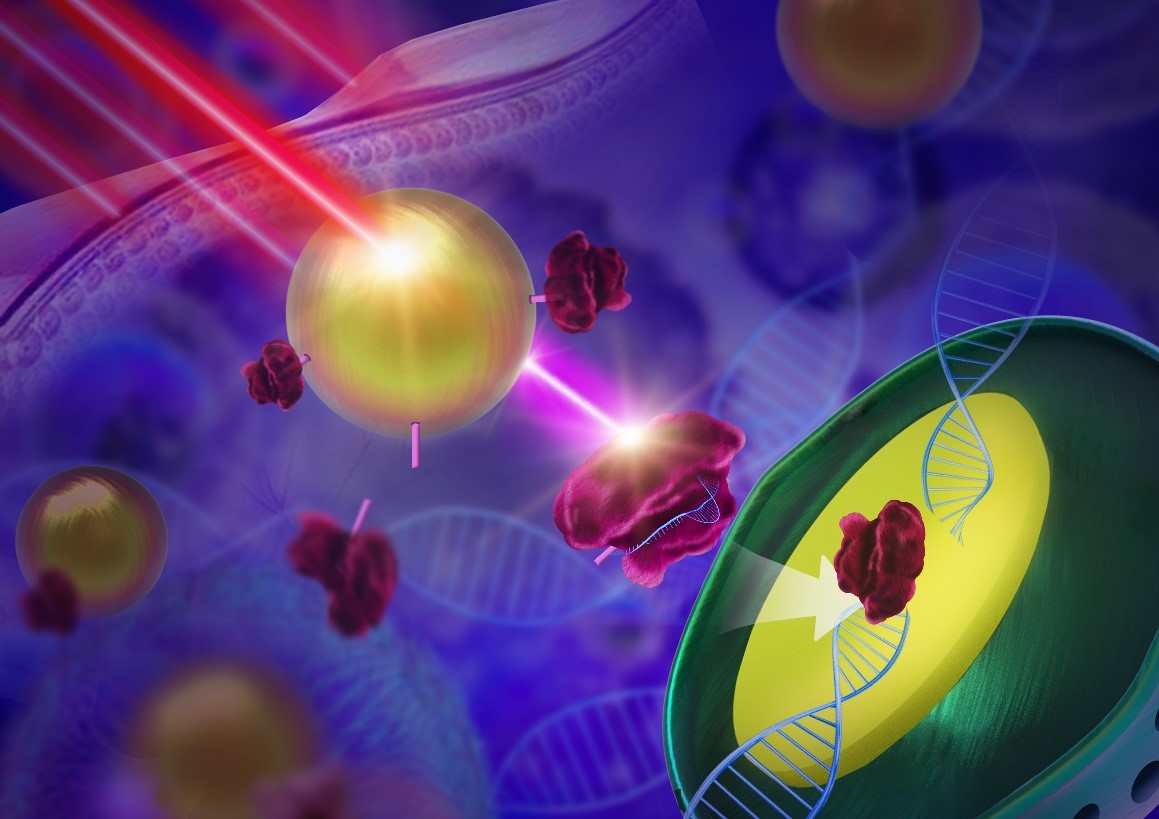
CRISPR-Cas9体系作为当前最热门的基因编辑工具,在癌症等重大疾病的治疗方面具有巨大的应用前景。然而,CRISPR-Cas9体系本身具有脱靶效应,如何利用CRISPR-Cas9体系进行精准治疗仍然是一大难题。 目前基于CRISPR-Cas9的治疗技术主要是通过靶向递送来实现的,一般是以病毒作为载体,而这些病毒载体可能会引发宿主细胞内部基因突变,导致细胞癌化,因此在临床的应用存在一定的风险。近年来,一些非病毒载体的也被开发并被用于CRISPR-Cas9体系中,但基于非病毒载体实现可控基因编辑的研究仍鲜有报道。
近日,厦门大学物理科学与技术学院林友辉副教授与南京大学宋玉君教授课题组、南京工业大学王玉珍副研究员合作设计了一种基于上转换纳米粒子的新型CRISPR-Cas9基因编辑载体体系。当这些粒子在近红外光照射下时,其中的上转换纳米粒子会发出紫外光,进而切断将CRISPR-Cas9拴在粒子上的光敏分子,从而使得CRISPR-Cas9体系进入细胞核,实施基因编辑。实验表明,这种远程操纵的基因编辑体系在细胞中和体内的皆表现出优异的近红外光响应的基因剪切能力。当CRISPR-Cas9靶向到一段肿瘤癌基因(Plk-1)后,可在红外光的调控下,对靶点基因实现敲除,从而诱发肿瘤细胞凋亡。该团队从基因,蛋白及细胞等多各个角度对该体系的有效性进行了验证。此外,这一体系在小鼠活体上的近红外光响应的能力也成功得到了验证。在对荷瘤小鼠进行治疗的过程中发现,只有近红外光照射实验组的肿瘤得到了有效抑制,且从20天后取下肿瘤大小来看,实验组肿瘤远远小于对照组。此外,由于红外光强大的组织穿透性,为其在人体深层组织中应用提供了潜在的可能。总之,该技术为非病毒载体的开发提供了新思路,同时为深度时空调控基因编辑打开了新的大门。
相关工作已发表于Science Advances ( DOI: 10.1126/sciadv.aav7199), Near-infrared upconversion activated CRISPR/Cas9 system: a remote-controlled gene editing platform.