目前,在纳米载药领域,发展在体内的、多功能、可降解纳米载体以及实现疾病诊疗一体化是一个具有挑战性的课题。吉林大学徐抒平教授课题组与中国科学院长春应用化学研究所金永东研究员团队联合开发了一种基于肿瘤微环境响应的智能可降解纳米反应器,用于癌症的化学-饥饿协同治疗;同时该纳米反应器具有细胞内葡萄糖水平的原位报告功能,用于疗效的即时反馈。
癌症对人类健康产生了巨大威胁,研究者们已经发展了一系列用于治疗癌症的方法,包括:手术切除、化学疗法、超声、光动力、光热以及放射疗法等。然而,这些策略会对周围正常组织产生或多或少的损害,甚至引发肿瘤转移。近几年,基于葡萄糖氧化酶(GOx)的饥饿疗法结合其他疗法实现协同增强治疗受到高度关注。该类方法中的关键问题是如何制备一种可降解的、对GOx高效负载的纳米载体,以实现对GOx的有效保护和肿瘤区域的靶向定点释放。
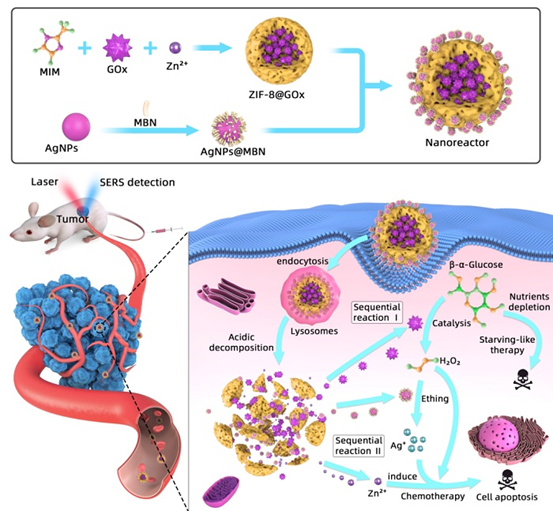
该研究构筑了一种以金属有机骨架MOF(ZIF-8)为载体的智能可降解纳米反应器用于协同治疗。该纳米反应器是由负载GOx的ZIF-8纳米颗粒(ZIF-8@GOx)及葡萄糖响应的表面增强拉曼散射(SERS)纳米探针(AgNPs@MBN)二者静电组装复合来实现的。细胞将纳米反应器内化至溶酶体后,癌细胞内的酸性微环境能够使ZIF-8骨架结构碎裂;在正常细胞的微环境下ZIF-8不发生碎裂。在癌细胞内,MOF的碎裂使得封装在内的GOx被逐渐释放,引发催化级联反应。该催化级联反应消耗了癌细胞内的葡萄糖,产物H2O2刻蚀SERS纳米探针(AgNPs@MBN)实现胞内原位葡萄糖传感。此反应生成物H2O2、Zn2+和Ag+离子均具有毒性,可促成对癌细胞的化学治疗,结合细胞内葡萄糖的消耗实现对癌细胞双效协同治疗。与此同时,由于H2O2对AgNPs的蚀刻作用导致拉曼信标分子(MBN)的SERS信号强度下降。因此,位于纳米反应器上的SERS探针可提供葡萄糖水平的原位反馈,实现对治疗过程的有效监管和评价。

这项工作具有以下优点:(1)该体系集成了体内传感葡萄糖和化学-饥饿协同治疗功能。(2)作为纳米反应器的主要元素,ZIF-8纳米载体可保护GOx免于失活,同时避免了纳米载体被免疫系统清除的风险。更重要的是它对肿瘤酸性微环境具有智能响应,可实现肿瘤处的药物(GOx)释放,这是针对癌症靶向治疗的关键步骤。(3)该纳米反应器可生物降解,可避免纳米材料长期体内积累而产生的毒副作用。(4)高效负载GOx和SERS纳米探针可提高癌症治疗效果并具有葡萄糖传感能力,实现疗效即时反馈。
作者将智能纳米反应器用于治疗宫颈癌细胞(HeLa)和植入了宫颈癌肿瘤的小鼠,获得了很好的治疗效果,且该纳米反应器治疗后在小鼠体内能够自行降解,对活体几乎没有产生毒副作用。
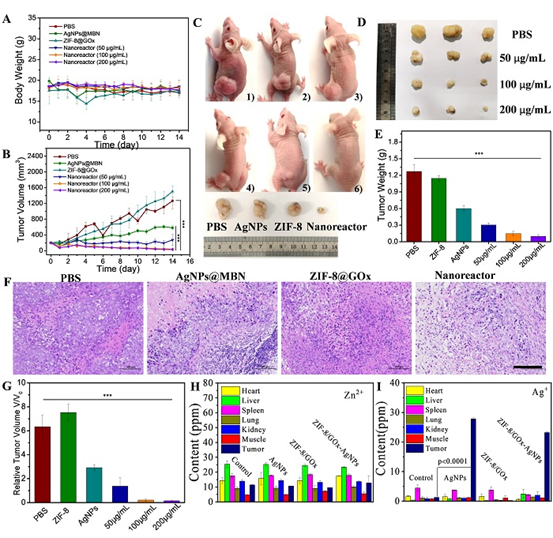
这一成果近期发表在iScience上,文章的共同第一作者是吉林大学博士研究生孙丹和中国科学院长春应用化学研究所助理研究员齐国华。这项工作为设计智能催化级联纳米系统用于生物医学领域的癌症治疗提供了参考。
原文:
https://www.cell.com/iscience/fulltext/S2589-0042(20)30460-0
X-MOL导师介绍
徐抒平
https://www.x-mol.com/university/faculty/75678
金永东
https://www.x-mol.com/groups/jin_yongdong
