当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Structural Changes and Aggregation Mechanisms of Two Different Dimers of an IgG2 Monoclonal Antibody
Biochemistry ( IF 2.9 ) Pub Date : 2018-08-24 00:00:00 , DOI: 10.1021/acs.biochem.8b00575 Jun Zhang 1 , Christopher Woods 1, 2 , Feng He 1 , Mei Han 3 , Michael J. Treuheit 1 , David B. Volkin 2
Biochemistry ( IF 2.9 ) Pub Date : 2018-08-24 00:00:00 , DOI: 10.1021/acs.biochem.8b00575 Jun Zhang 1 , Christopher Woods 1, 2 , Feng He 1 , Mei Han 3 , Michael J. Treuheit 1 , David B. Volkin 2
Affiliation
|
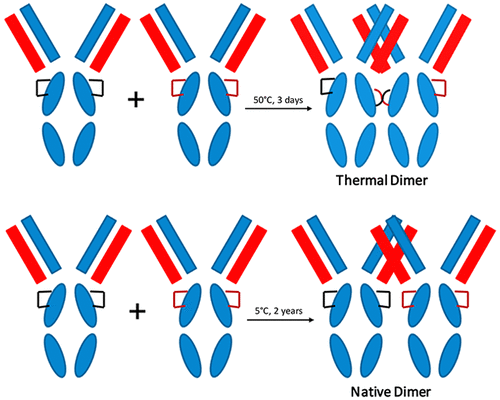
Protein therapeutics, monoclonal antibodies (mAbs) in particular, are large, structurally complex molecules that are prone to numerous modes of degradation during their production and long-term storage. Physical degradation via protein aggregation is a major concern when developing protein therapeutic candidates for clinical use. A dimer is perhaps the simplest element of protein aggregation, and thus, a better understanding of protein dimers in terms of their structures, intermolecular interactions, and chemical nature will help in the development of rational strategies for reducing aggregation propensity. In this study, two different mAb dimers were generated from an IgG2 monoclonal antibody solution, i.e., a native dimer generated under long-term storage and a thermal dimer from a thermal stress condition. Both IgG2 dimers were characterized in terms of their chemical and physical properties, bioactivity, and conformational dynamics. The native IgG2 dimer was formed mainly through noncovalent association. It displayed minimal differences in biophysical properties and higher-order structure compared to the monomer yet showed compromised in vitro potency, likely because of steric hindrance. In contrast, the thermal IgG2 dimer was mainly disulfide-linked, but even so, no new non-native disulfide bonds were detected by peptide mapping. Two regions within the Fc-CH2 domain of the thermal IgG2 dimer exhibited significantly increased flexibility as measured by hydrogen–deuterium exchange mass spectrometry, and notably, these regions are connected by an intrachain disulfide bond under natively folded conditions. These findings provide a better understanding of dimer formation under long-term storage and thermal stress conditions for this IgG2 mAb, and possible aggregation mechanisms are discussed.
中文翻译:

IgG2单克隆抗体的两个不同二聚体的结构变化和聚集机制
蛋白质治疗药物,尤其是单克隆抗体(mAb),是结构复杂的大分子,在其生产和长期保存过程中易于发生多种降解模式。当开发用于临床用途的蛋白质治疗候选物时,通过蛋白质聚集进行的物理降解是主要关注的问题。二聚体可能是蛋白质聚集的最简单元素,因此,对蛋白质二聚体的结构,分子间相互作用和化学性质的更好理解将有助于开发降低聚集倾向的合理策略。在这项研究中,从IgG2单克隆抗体溶液中产生了两种不同的mAb二聚体,即,在长期保存下产生的天然二聚体和在热应激条件下产生的热二聚体。两种IgG2二聚体均以其化学和物理性质,生物活性和构象动力学为特征。天然IgG2二聚体主要通过非共价结合形成。与单体相比,它在生物物理特性和高阶结构上显示出最小的差异,但在体外效能上却受到了损害,这可能是由于空间位阻所致。相反,热IgG2二聚体主要是二硫键连接的,但是即使如此,通过肽谱分析也未检测到新的非天然二硫键。Fc-C内的两个区域 与单体相比,它在生物物理特性和高阶结构上显示出最小的差异,但在体外效能上却受到了损害,这可能是由于空间位阻所致。相反,热IgG2二聚体主要是二硫键连接的,但是即使如此,通过肽谱分析也未检测到新的非天然二硫键。Fc-C内的两个区域 与单体相比,它在生物物理特性和高阶结构上显示出最小的差异,但在体外效能上却受到了损害,这可能是由于空间位阻所致。相反,热IgG2二聚体主要是二硫键连接的,但是即使如此,通过肽谱分析也未检测到新的非天然二硫键。Fc-C内的两个区域通过氢-氘交换质谱法测得,热IgG2二聚体的H 2结构域显示出显着增加的柔性,并且值得注意的是,这些区域在天然折叠条件下通过链内二硫键连接。这些发现为该IgG2 mAb在长期存储和热应激条件下的二聚体形成提供了更好的理解,并讨论了可能的聚集机制。
更新日期:2018-08-24
中文翻译:

IgG2单克隆抗体的两个不同二聚体的结构变化和聚集机制
蛋白质治疗药物,尤其是单克隆抗体(mAb),是结构复杂的大分子,在其生产和长期保存过程中易于发生多种降解模式。当开发用于临床用途的蛋白质治疗候选物时,通过蛋白质聚集进行的物理降解是主要关注的问题。二聚体可能是蛋白质聚集的最简单元素,因此,对蛋白质二聚体的结构,分子间相互作用和化学性质的更好理解将有助于开发降低聚集倾向的合理策略。在这项研究中,从IgG2单克隆抗体溶液中产生了两种不同的mAb二聚体,即,在长期保存下产生的天然二聚体和在热应激条件下产生的热二聚体。两种IgG2二聚体均以其化学和物理性质,生物活性和构象动力学为特征。天然IgG2二聚体主要通过非共价结合形成。与单体相比,它在生物物理特性和高阶结构上显示出最小的差异,但在体外效能上却受到了损害,这可能是由于空间位阻所致。相反,热IgG2二聚体主要是二硫键连接的,但是即使如此,通过肽谱分析也未检测到新的非天然二硫键。Fc-C内的两个区域 与单体相比,它在生物物理特性和高阶结构上显示出最小的差异,但在体外效能上却受到了损害,这可能是由于空间位阻所致。相反,热IgG2二聚体主要是二硫键连接的,但是即使如此,通过肽谱分析也未检测到新的非天然二硫键。Fc-C内的两个区域 与单体相比,它在生物物理特性和高阶结构上显示出最小的差异,但在体外效能上却受到了损害,这可能是由于空间位阻所致。相反,热IgG2二聚体主要是二硫键连接的,但是即使如此,通过肽谱分析也未检测到新的非天然二硫键。Fc-C内的两个区域通过氢-氘交换质谱法测得,热IgG2二聚体的H 2结构域显示出显着增加的柔性,并且值得注意的是,这些区域在天然折叠条件下通过链内二硫键连接。这些发现为该IgG2 mAb在长期存储和热应激条件下的二聚体形成提供了更好的理解,并讨论了可能的聚集机制。































 京公网安备 11010802027423号
京公网安备 11010802027423号