《细胞》重大突破:科学家首次证实,他汀类降脂药可以巧妙解除「超级细菌」的耐药性 | 科学大发现
本文获“奇点网”授权转载
1928年,亚历山大·弗莱明发现了青霉素,开启了抗生素拯救人类的历史。
然而,在这个抗生素使用了几年之后,一些金黄色葡萄球菌为了生存,被迫进化出了专门降解抗生素的β-内酰胺酶。没过多久,约50%的金黄色葡萄球菌感染用青霉素已经无效了(1)。

为了杀灭这部分金黄色葡萄球菌,1959年,科学家又开发了新型青霉素类抗生素。然而好景不长,两年之后的1961年(2),英国首先报告了耐受当时所有青霉素类抗生素的超级耐药的耐甲氧西林金黄色葡萄球菌(MRSA)。
两年的时间搞定一个抗生素,看来细菌还给人类科学家留了不少时间嘛。
事实真是这样吗?
去年9月份,《科学》杂志刊登了哈佛大学和以色列理工学院一项关系细菌耐药进化的研究(3),他们的研究成果在社会上引起了轩然大波。因为他们发现,在实验室条件下,大肠杆菌产生对抗1000倍于原始致死量的抗药性,仅仅需要10天时间。当研究人员换一种抗生素后,也观察到类似的现象。而他们给研究过程录制的视频,更是触目惊心。

黑底的培养基从两边到中间分成5个浓度梯度(0-1000倍),培养基上面是白色的细菌从两边往中间(抗生素浓度由高到底)逐渐往中间生长
看到了吗?只需10天,它们就能获得1000倍,甚至10万倍于原始致死量的抗药性(3)。
而人类发现一种新的抗生素,少则需要一两年,多则需要一二十年(4)。更要命的是,从1990年以来,人类几乎没有发现新的抗生素种类了(5)。世界卫生组织今年9月份宣布,「确认世界的抗生素频临枯竭」(6)。
抗生素诞生时间线(4)
据世界卫生组织统计,目前MRSA已经在全球大面积蔓延,很多地区90%以上的感染事件是由MRSA引起的;而且,MRSA感染者的死亡风险比普通金黄色葡萄球菌高出64%左右(7)。
形式很不乐观!留给人类的时间不多了。

就在MRSA肆意横行,不断攻城略地,把新抗生素挑下马的时候,却意外地栽在了他汀类药物的脚下。
对,你没看错,就是降血脂的那个他汀类药物。
近日,西班牙和德国的联合研究团队将他们的这一重磅研究成果刊登在顶级期刊《细胞》杂志上(8)。给即将到来的「世界提高抗生素认识周」(11月13日-19日)增添了一丝丝正能量。
Daniel Lopez是细菌感染领域的专家,早在2010年在哈佛大学医学院做博后的时候,他就在微生物膜领域大牛Roberto Kolter的指导下,独立发现了在细菌枯草芽孢杆菌的细胞膜上也存在与真核生物类似的「脂筏」(9)。

Daniel Lopez教授
脂筏像移动的岛屿一样漂浮在细胞膜上,与膜的信号转导、蛋白质分选均有密切的关系,在细胞的生命过程中起到非常重要的作用。脂筏的破坏与各种各样的人类疾病有关,包括阿尔茨海默病,帕金森病,心血管疾病(10)。

漂浮在细胞膜上脂筏(粉色)
不过,对于细菌这种原核生物上是否存在类似的「脂筏」,学界并不清楚。Lopez和他的导师证明,细菌细胞膜的表面不仅有类似「脂筏」的功能区(FMMs),而且他们也在细菌的FMMs里发现了涉及信号传导和运输的蛋白质。同时他们还发现,如果破坏细菌的FMMs会影响细菌细胞膜的生成和蛋白的分泌,但不影响细菌的生存能力。
不过,此时对于FMMs的具体生理功能Lopez还是不清楚。那么既然是自己发现的这玩意儿,就自己来解密吧。
经过近7年的努力,Lopez教授团队终于解开了FMMs的具体结构。他们发现,构成FMMs的脂类不是组成组成细胞膜的磷脂,而是一种特殊的类胡萝卜素衍生的脂类,通过细胞膜染色可以很好的将二者区分开。此外,他们还利用先进的成像技术观察到了FMMs的存在。

在显微镜下不停的变焦,可以清晰的看到FMMs的存在
最让Lopez教授团队感到兴奋的可能是,他们在FMMs上发现了PBP2a蛋白。
弗莱明发现的青霉素之所以能够杀菌,主要原因就是青霉素结合在细菌表面的PBP蛋白上,而这个蛋白的功能之一是促进细菌细胞壁的合成。所以,一旦青霉素结合到PBP上,金黄色葡萄球菌就失去了分裂增殖的能力。
被折腾的死去活来的金黄色葡萄球菌实在是受不了青霉素类抗生素了。直到某一天,一个金黄色葡萄球菌意外从其他微生物那里获得了一个叫做mecA的基因,就是这个基因编码了也能合成细胞壁的PBP2a蛋白(1)。而正是PBP2a蛋白让青霉素类抗生素对金黄色葡萄球菌再也无法下手。
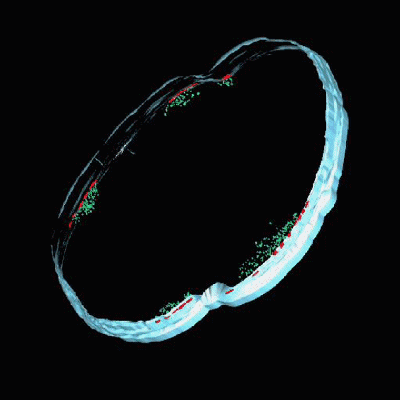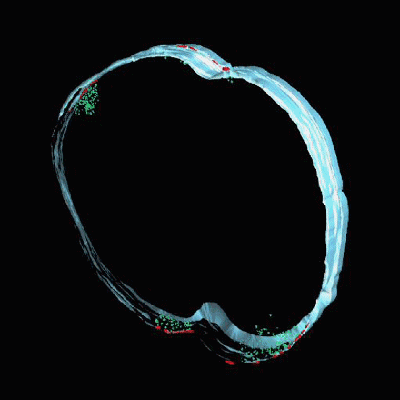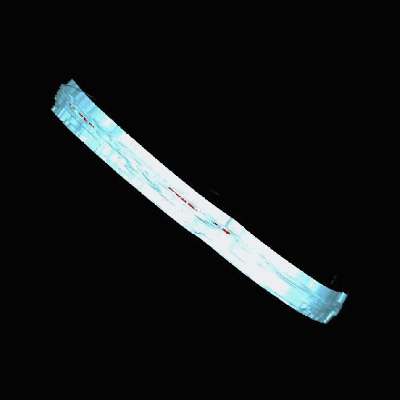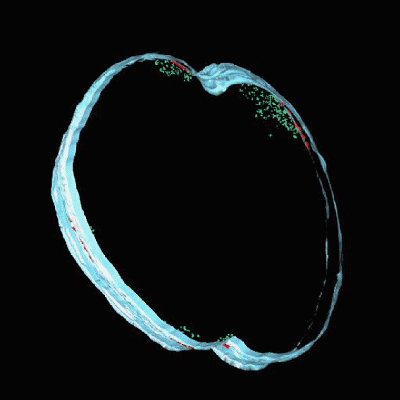
FMMs的模拟图,那些红红绿绿的就是
现在科学家已经知道,PBP就像一个遇到危险不但不会蜷成一团,反而会把自己的白肚皮暴露出来的作死刺猬。一遇到青霉素注定要挂。
而这个外来的刺猬PBP2a就不一样了,它们在细胞膜上是一对一对抱在一起出现的,把自己的活性位点深深地隐藏起来了,看你青霉素类抗生素从哪里下口。啊哈哈哈。。。
之前就有研究暗示,细菌的耐药性与FMMs有关,这回算是被Lopez教授团队证实了。那是不是可以在这里做做文章,解决MRSA的耐药性问题呢?

美丽的脂筏(黄色)图:RIKEN Synthetic Organic Chemistry Laboratory
「既然我们已经知道与细菌耐药性有关的蛋白在FMMs里,那么我们可以通过摧毁这些区域,消除细菌的耐药性,」Lopez教授说,「我们设计了一个分子,成功地破坏了FMMs,我们真的消除了这些细菌的耐药性。」(11)
Lopez教授说的这个分子就是他汀类分子。之所以选择他汀类,主要是因为构成FMMs的脂类和胆固醇的合成都需要甲戊二羟酸途径,而他汀类药物降血脂,就是通过抑制这个途径完成的。就这样,他汀类药物就阴差阳错地破坏了细菌细胞膜上的FMMs。
一旦他汀类分子将FMMs的基本架构破坏了,没了根基,PBP2a就不能抱在一起了,这时候它们的活性位点又暴露了。就在这转瞬间,MRSA就从耐青霉素类抗生素变成不耐了。
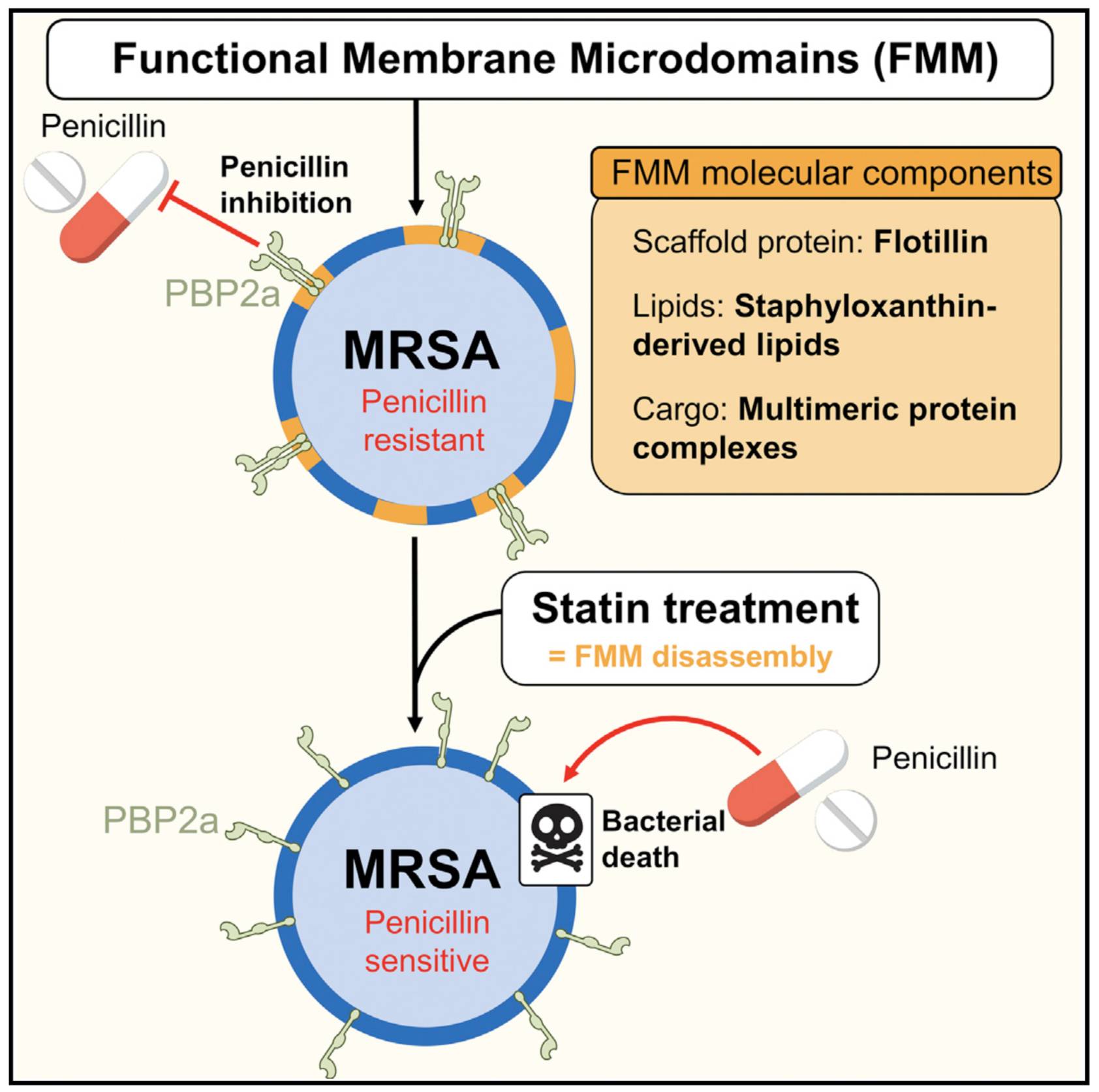
有FMMs的时候,PBP2a并列在一起,耐青霉素;
FMMs被破坏之后,PBP2a不能聚合,MRSA又对青霉素敏感
实际上,早在2001年就有人在临床研究中发现,他汀类药物对感染的治疗有帮助(12),随后的数年间也有不少团队在临床上观察到了这个现象(13,14,15)。不过也有人表示他汀类药物没有这个效果(16,17)。当时,这种前后矛盾的临床结果让研究人员无所适从。
对此,研究人员表示,实际上这种现象是正常的,因为他汀类药物对FMMs的破坏,依赖于甲戊二羟酸途径,但是并不是所有的细菌都有这个途径(18)。
有了这个研究结果之后,研究人员建议,可以考虑采用甲氧西林联合他汀类药物治疗MRSA导致的感染。
「我们为战胜超级细菌打开了一个新的方向,」Lopez教授说,「而且这种治疗方式不易让细菌产生新的耐药性。因为,他汀类药物没有给MRSA造成生存的压力,所以他们不会促进新型的耐药性产生。」
参考资料:
1、Fishovitz, J., Hermoso, J.A., Chang, M., and Mobashery, S. (2014). Penicillin-binding protein 2a of methicillin-resistant Staphylococcus aureus. IUBMB Life 66, 572–577.
2、Jevons, M. P. (1961) Celbenin resistant staphylococci. BMJ 1, 124–125. 3、Michael Baym et al, Spatiotemporal microbial evolution on antibiotic landscapes. Science 09 Sep 2016: Vol. 353, Issue 6304, pp. 1147-1151.
4、Silver,L.L. Challenges of Antibacterial Discovery.In Clinical Microbiology Reviews,2011,24:71-109.
5、http://apps.who.int/iris/bitstream/10665/258965/1/WHO-EMP-IAU-2017.11-eng.pdf?ua=1
6、http://www.who.int/mediacentre/news/releases/2017/running-out-antibiotics/zh/
7、http://www.who.int/mediacentre/news/releases/2014/amr-report/zh/
8、Daniel Lopez et al, Membrane Microdomain Disassembly Inhibits MRSA Antibiotic Resistance. 2017, Cell 171, 1–14.
9、Daniel López1 et al, Functional microdomains in bacterial membranes. Genes & Dev. 2010. 24: 1893-1902.
10、Michel V, Bakovic M. 2007. Lipid rafts in health and disease. Biol Cell 99: 129–140.
12、Liappis, A.P., Kan, V.L., Rochester, C.G., and Simon, G.L. (2001). The effect of statins on mortality in patients with bacteremia. Clin. Infect. Dis. 33, 1352–1357.
13、Falagas, M.E., Makris, G.C., Matthaiou, D.K., and Rafailidis, P.I. (2008). Statins for infection and sepsis: a systematic review of the clinical evidence. J. Antimicrob. Chemother. 61, 774–785.
14、Lopez-Cortes, L.E., Galvez-Acebal, J., Del Toro, M.D., Velasco, C., de Cueto, M., Caballero, F.J., Muniain, M.A., Pascual, A., and Rodrı́guez-Ban, J. (2013). Effect of statin therapy in the outcome of bloodstream infections due to Staphylococcus aureus: a prospective cohort study. PLoS ONE 8, e82958.
15、Parihar, S.P., Guler, R., Khutlang, R., Lang, D.M., Hurdayal, R., Mhlanga, M.M., Suzuki, H., Marais, A.D., and Brombacher, F. (2014). Statin therapy reduces the mycobacterium tuberculosis burden in human macrophages and in mice by enhancing autophagy and phagosome maturation. J. Infect. Dis. 209, 754–763.
16、Bergman, P., Linde, C., Putsep, K., Pohanka, A., Normark, S., Henriques-Normark, B., Andersson, J., and Bjorkhem-Bergman, L. (2011). Studies on the antibacterial effects of statins–in vitro and in vivo. PLoS ONE 6, e24394.
17、Wan, Y.D., Sun, T.W., Kan, Q.C., Guan, F.X., and Zhang, S.G. (2014). Effect of statin therapy on mortality from infection and sepsis: a meta-analysis of ran- domized and observational studies. Crit. Care 18, R71.
18、Heuston, S., Begley, M., Gahan, C.G., and Hill, C. (2012). Isoprenoid biosynthesis in bacterial pathogens. Microbiology 158, 1389–1401.
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号