Science实锤“病从口入”
俗话说“病从口入”,这种经验之谈究竟有几分科学道理呢?
人体内环境其实非常复杂,咱们的肠道里寄生着大量微生物,据说菌落重达几公斤。肠道定居的微生物对维持体内平衡有重要作用。不过,一些时候有潜在致病能力的细菌也会混在其中,诱发肠道炎症,比如肝螺杆菌(Helicobacter hepaticus)。肠道微生物和宿主的免疫系统间有很多联系,有时可维护肠道健康,有时则相反,其结果取决于肠道微生物的种类、免疫应答、宿主的遗传因素和其他环境因素等等。著名杂志《经济学人》(The Economist)曾以“Microbes maketh man”为题专门探讨过微生物对人类的重要性(下图)。

图片来源:The Economist
对于那些原本就住在肠道里的微生物,我们的免疫系统早已有了应对的措施,某种程度上可以说已经驯服了这些微生物。但如果细菌“外来户”侵入了肠道,肠道的免疫系统可能就有点犯怵了。科学界已经知道口腔里的细菌如果定居到肠道会引起多种炎性疾病,不过人类的口腔里细菌种类也不少,究竟是哪些口腔细菌会给肠道带来麻烦呢?最近,来自日本庆应义塾大学(Keio University)医学院的Kenya Honda和早稻田大学的Masahira Hattori等研究者在Science 杂志发表文章,证明了唾液微生物群落中的克雷伯菌(Klebsiella)移植到肠道中,会诱发慢性肠道炎症。
克雷伯菌形态示意图。图片来源:Science
为了鉴定出能够移植肠道并持续导致慢性炎症的菌株,研究者将两名克罗恩病(Crohn's disease,又称局限性肠炎)患者的唾液植入无菌小鼠的肠道中。他们发现移植了唾液的小鼠的排泄物与对照组的小鼠不同,主要是肠道T辅助细胞1(T helper 1,TH1)的量有变化。他们发现,一种肺炎克雷伯菌(Klebsiella pneumoniae)菌株Kp-2H7是诱导TH1细胞介导的炎性免疫反应的“主犯”。这种克雷伯菌对多种抗生素有抵抗力,包括氨苄青霉素和泰乐菌素。无特定病原体(SPF)的小鼠对Kp-2H7的肠道定植具有抗性,不过用氨苄青霉素或泰乐菌素处理后,Kp-2H7就可以在小鼠肠道中持续存活,同时TH1细胞数量也会增长。
尽管来源于口腔的克雷伯菌Kp-2H7在野生型小鼠体内不能诱导结肠炎,但会诱导白细胞介素10(IL-10)缺陷小鼠发生严重的结肠炎症状。这表明微生物和宿主肠道免疫系统发生相互作用时,是否发生有害的炎症反应还取决于一些特定的情况,比如抗生素诱导的微生物群落扰动或者宿主的遗传因素。
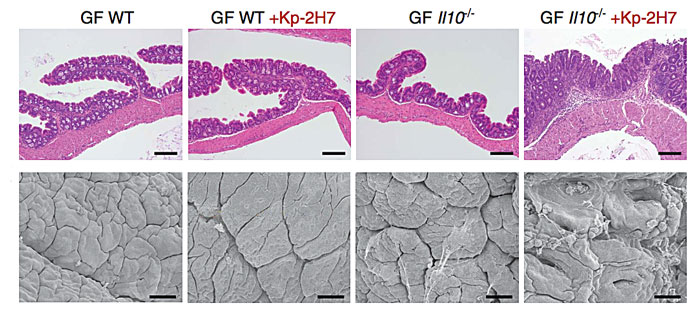
野生型小鼠的肠道不受克雷伯菌Kp-2H7影响,但IL-10缺陷小鼠则会因Kp-2H7产生炎症。图片来源:Science
肠道微生物能够调节宿主先天性免疫和获得性免疫两种免疫应答方式,甚至会影响宿主对某种治疗方式(如癌症免疫疗法)的响应性。在我们的免疫系统中,不同的病原体会诱导不同类型T细胞亚型的极化。有意思的是,迁移到肠道的克雷伯菌Kp-2H7不影响抗炎的调节性T细胞,反而会诱导肠道炎性TH1细胞的产生,这说明其中的机制或许与众不同。越来越多的证据表明,口腔和肠道微生物生物群对于非肠道炎性疾病,如心血管疾病、自身免疫性脑脊髓炎和关节炎的发作和进展都具有显著影响,其中的关键就是诱导产生可迁移到远处发炎组织的炎性免疫细胞。
为了研究克雷伯菌Kp-2H7诱导的TH1细胞介导炎症反应的机制,研究者使用了几种缺乏某些先天性免疫应答和获得性免疫应答的小鼠模型。他们发现,树突细胞(DC)通过Toll样受体4(TLR4)信号通路诱导了这种特异性的TH1细胞免疫应答。而且,受TLR4信号激活的上皮细胞会产生白细胞介素-18(IL-18),能进一步放大这种TH1细胞免疫应答。
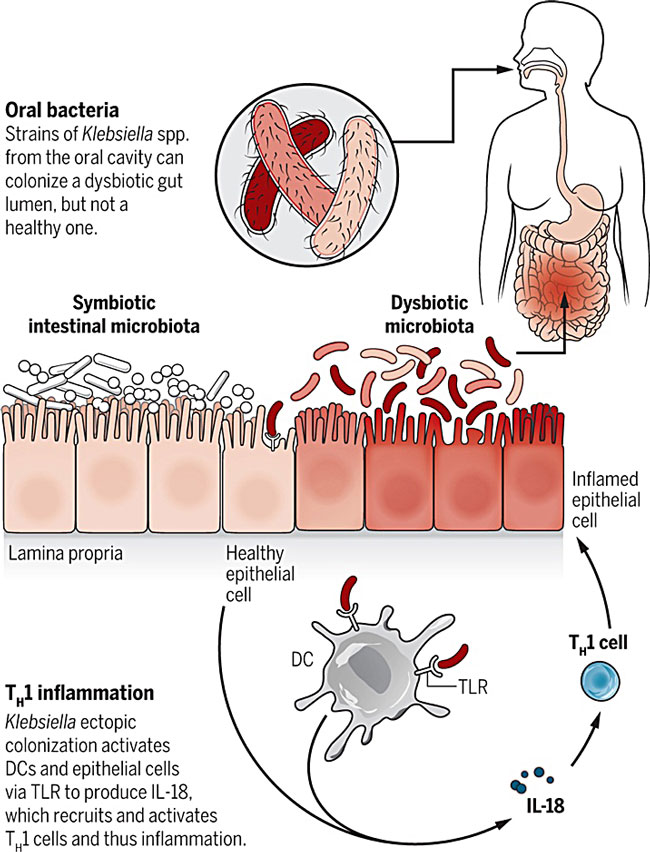
口腔细菌诱发慢性肠炎的机制。图片来源:Science
研究者还发现了与Kp-2H7十分类似的另一种克雷伯菌(Klebsiella aeromobilis)菌株Ka-11E12,它来自一位溃疡性结肠炎患者的唾液样本,对抗生素有耐药性,可诱导特异性的TH1细胞免疫应答,还可在IL-10缺陷小鼠中引发严重的肠道炎症。更惊人的是,一种来自健康人唾液样品的肺炎克雷伯菌(Klebsiella pneumoniae)菌株Kp-40B3,也可以在肠道中诱导类似的TH1细胞免疫应答。这说明其他克雷伯菌菌株或者克雷伯菌以外的其他细菌,都可能是类似的潜在炎性肠道疾病的病原体。(赶快去立项啊……)
这一结果在临床上意义重大,这是科学家第一次如此清晰而有力地证明来自口腔的细菌能直接导致肠道疾病,并且也可能参与其他很多疾病的病理过程。“病从口入”不再只是一句经验之谈,而是有了坚实的科学证据。
同期Science 上还刊登了中国医学科学院曹雪涛院士对这一工作的评论文章“Intestinal inflammation induced by oral bacteria”(Science, 2017, 358, 308-309)。
此外,这一研究也再次证明了微生物群落对人类的重要性。哪些微生物是人体的“友好居民”?哪些是“不法分子”?人体的免疫系统如何识别?这些问题都有待更多的研究去探讨。但毫无疑问的是,微生物群落对维持人体肠道稳态和身体健康起到了关键作用,这对药物研发和用药安全都是重要的启示。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Ectopic colonization of oral bacteria in the intestine drives TH1 cell induction and inflammation
Science, 2017, 358, 359-365, DOI: 10.1126/science.aan4526
(本文由氘氘斋供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号