侯召民课题组JACS:B(C6F5)3催化的硅烷交叉复分解反应
有机硅化合物在有机合成化学及材料科学领域具有重要的应用。其中,氢化硅烷通过C-Si和Si-H键的断裂和重组形成其他多种不同有机硅化合物的研究引起了研究者密切的关注。尽管氢化硅烷的化学键重组在概念上十分新颖,并且在有机合成中具有潜在的应用价值,但该类反应通常作为过渡金属催化的去氢偶联反应的副反应出现,或在化学计量的过渡金属络合物作用下完成相应的转化。以催化过程实现转化的反应包括在[Ph3C][B(C6F5)4]的作用下,三取代的氢化硅烷可以转化为相应的三芳基硅正离子,但该类反应的选择性较差,底物适用性有限。另一方面,两种不同的氢化硅烷发生C-Si/Si-H键的选择性交叉复分解的过程也尚无报道。
近日,日本理化学研究所(RIKEN)的侯召民(Zhaomin Hou)教授(点击查看介绍)课题组报道了他们利用富电子芳香烃取代的氢硅化烷作为底物,首次在硼催化剂B(C6F5)3的作用下实现一系列氢化硅烷的选择性C-Si/Si-H键自身和交叉复分解反应。该反应可以高选择性地得到双芳基硅目标产物,具有良好的底物适用性。相关论文发表在J. Am. Chem. Soc. 杂志上,第一作者是马元鸿(Yuanhong Ma)博士,张亮(Liang Zhang)教授和侯召民教授为通讯作者。
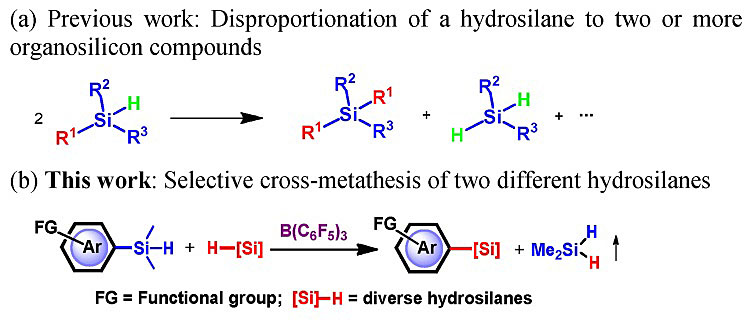
图1. 氢化硅烷的取代基重组。图片来源:J. Am. Chem. Soc.
硼路易斯酸(如B(C6F5)3)近年来在Si-H键活化和高效转化中引起了较多的重视,侯召民课题组曾经在研究B(C6F5)3催化芳基C-H键的硅基化反应时注意到一些氢化硅烷可以在B(C6F5)3的作用下进行重组(J. Am. Chem. Soc., 2016, 138, 3663),于是他们对这一现象开展了深入的研究。

实验室中的侯召民教授(中)。图片来源:RIKEN
基于前期在富电子芳香烃C-H键的硅基化反应中积累的经验,作者首先尝试了含有富电子芳香烃取代基的三取代氢化硅烷的自身复分解反应进行考察,如图2所示,底物1在5 mol%的B(C6F5)3作用下,以氯苯作为溶剂加热至100 ℃反应24小时,N,N-二烷基取代芳香烃修饰的三取代氢化硅烷底物都能以中等到良好的产率发生反应,生成一分子二甲基氢化硅烷的同时得到二芳基硅烷化合物2,氮还可以修饰三氟甲基(2c),芳香环上也可以进行氟、溴等卤原子取代,除此之外,二茂铁取代基修饰的氢化硅烷也能以81%的产率发生自身复分解反应得到产物2k。
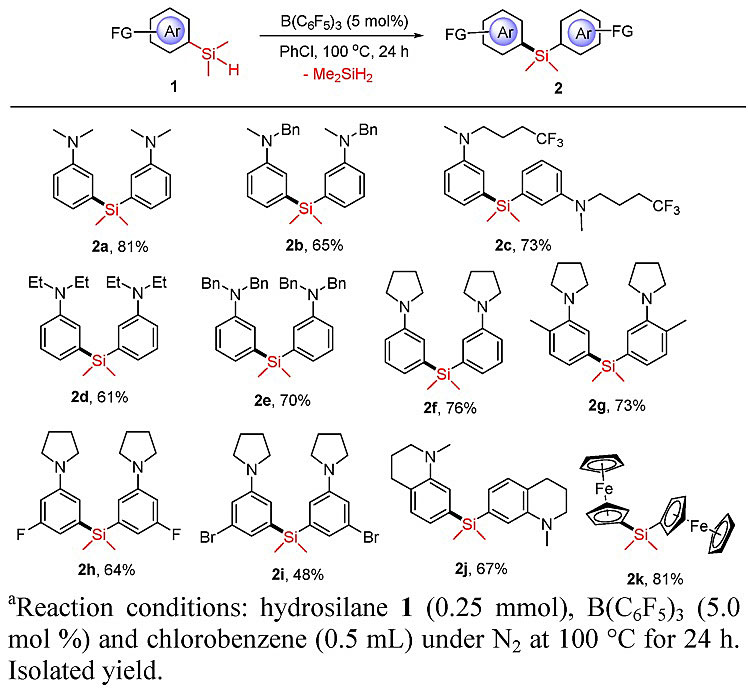
图2. 氢化硅烷自身复分解反应的底物拓展。图片来源:J. Am. Chem. Soc.
除了自身复分解反应外,作者还对富电子芳香烃取代的氢化硅烷1和苯基二甲基氢化硅烷3a的交叉复分解反应进行考察,如图3所示,他们以(m-Me2NC6H4)Me2SiH 1a作为模板底物与2当量的PhMe2SiH混合,在5 mol%的B(C6F5)3作用下,以氯苯作为溶剂加热至100 ℃反应24小时,底物1a中芳基和硅之间的C-Si键发生断裂,以79%的产率得到交叉偶联的产物4。其他13种富电子芳香烃取代的底物也都取得了中等到优秀的产率,其中产物4a的盐酸盐还通过X射线单晶衍射进行结构确定。
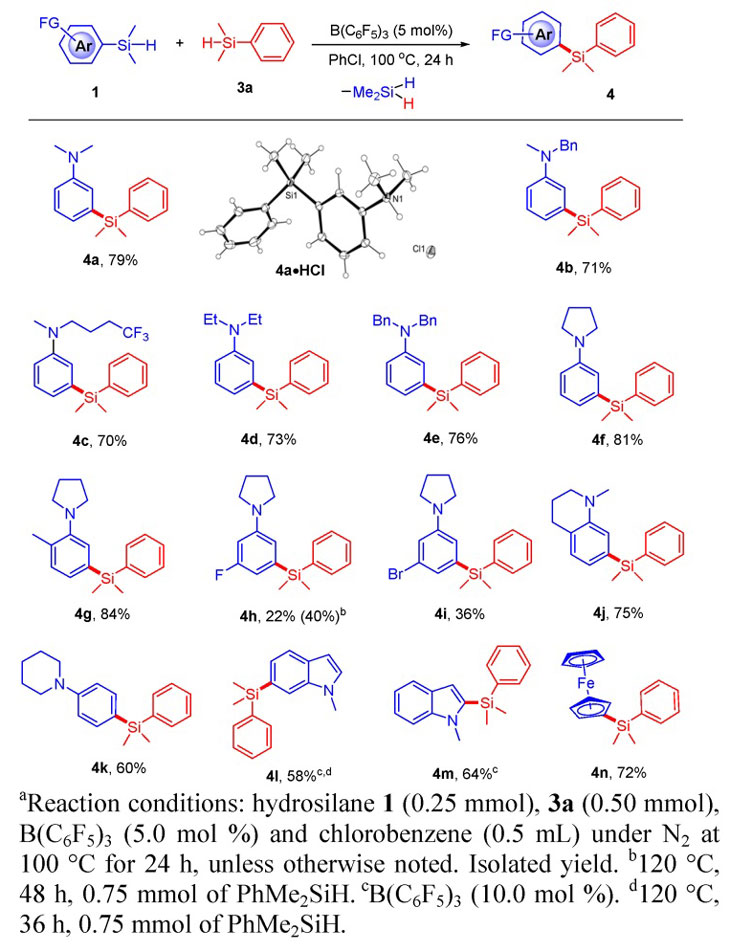
图3. 氢化硅烷的交叉复分解反应。图片来源:J. Am. Chem. Soc.
随后他们固定其中一个富电子芳香烃取代的氢化硅烷底物为1a,考察另一氢化硅烷底物3中不同富电子芳香烃取代对反应的影响。在同样条件下,1a中芳基和硅之间的C-Si键发生断裂,随后与3进行交叉复分解反应得到双芳基硅产物5,23种底物均取得了中等到良好的收率,底物3也可以是芳香杂环、烯烃、炔烃、烷基等基团取代的氢化硅烷,反应表现出良好的官能团兼容性。
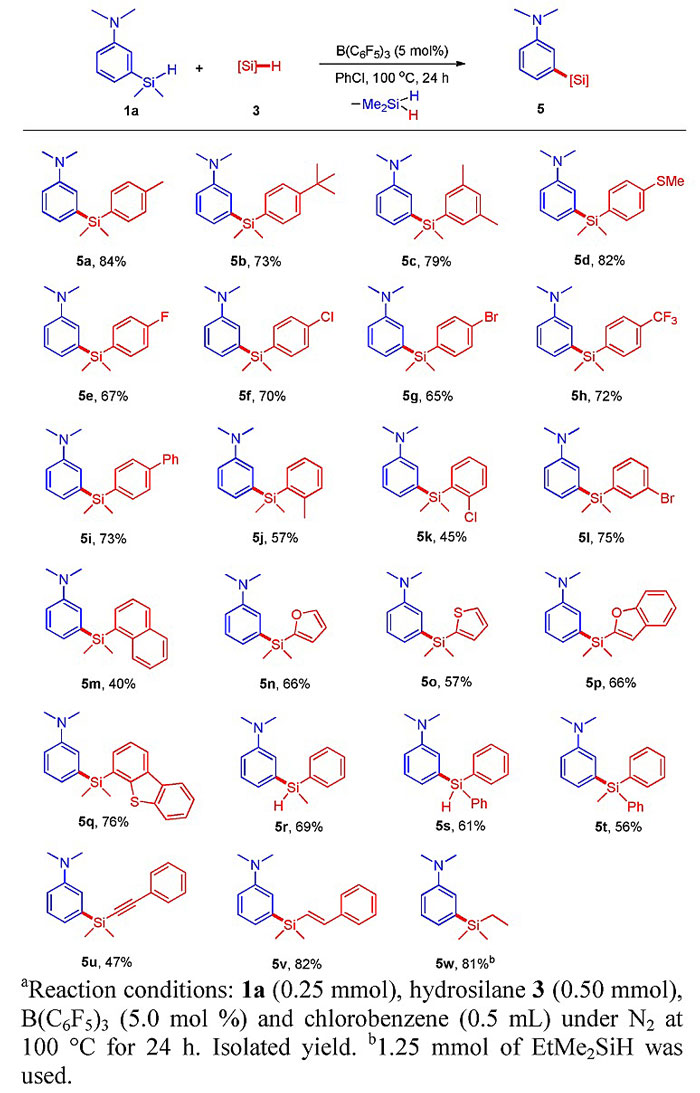
图4. 氢化硅烷的交叉复分解反应底物的进一步拓展。图片来源:J. Am. Chem. Soc.
作者还对产物做进一步的衍生化,分别从交叉复分解产物4a和5i出发,与MeOTf反应形成相应的季铵盐,然后分别与硼酸7、格氏试剂9在镍或者钯催化剂的作用下发生交叉偶联反应,以良好的产率得到产物8或者10。而当在镍催化剂的作用下,季铵盐和异丙醇钠会发生脱氨反应得到化合物11,说明该类交叉复分解的产物具有十分重要的应用价值。
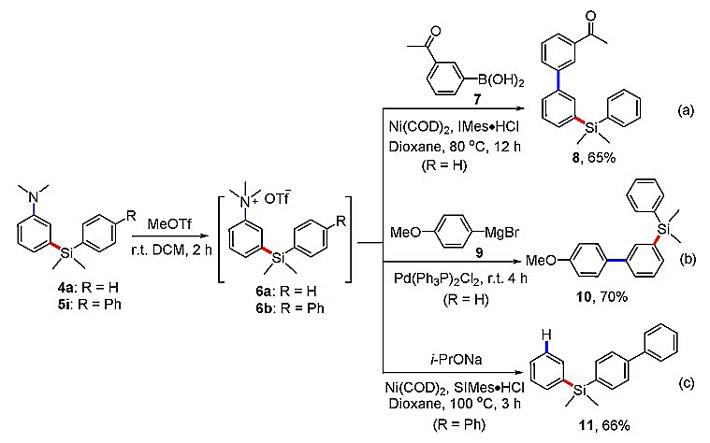
图5. 产物的衍生化实验。图片来源:J. Am. Chem. Soc.
为了进一步研究反应的机理,作者设计了4组对照实验,如图6所示,富电子芳香烃取代的氢化硅烷底物1a和甲基氘代的氢化硅烷Ph(CD3)2SiH 3a-d 反应得到氘代的产物4a-d,说明1a中富电子的Me2NC6H4基团迁移至3a-d 的硅原子。(m-Me2NC6H4)Me3Si 1a-Me和3a反应可以选择性地得到4a。而1a和PhMe3Si 3a-Me混合仅得到1a自偶联的产物2a,没有观察到交叉偶联的产物。底物3a的自身交叉复分解十分缓慢,仅仅得到痕量的产物2-Ph。以上结果表明,在Lewis酸B(C6F5)3作用下,富电子芳香烃更容易发生迁移,从而揭示了N,N-二甲基取代芳香烃的氢化硅烷底物1a比苯基氢化硅烷3a反应活性更高的原因。Si-H键在反应中十分重要,四取代的硅烷不发生反应。
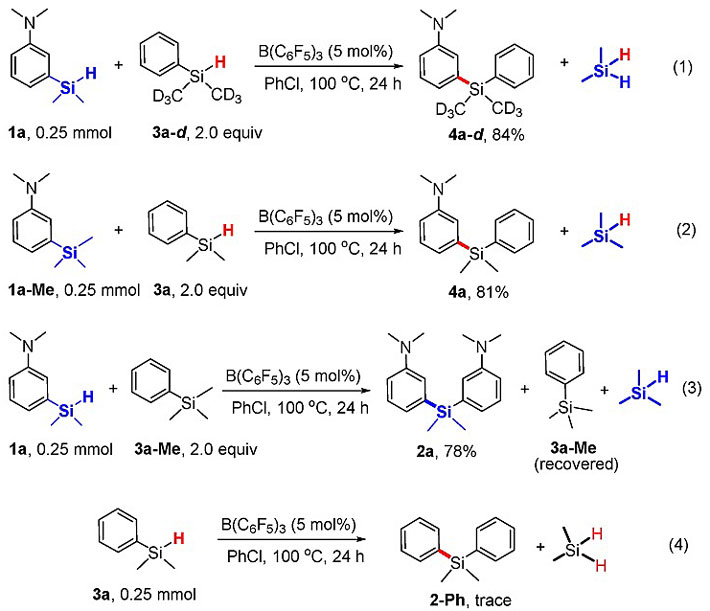
图6. 不同三取代、四取代硅烷的复分解反应。图片来源:J. Am. Chem. Soc.
因此,作者提出了如图7所示的机理,B(C6F5)3先与底物3a结合形成中间体A,随后1a从Si-H键的背面进攻,经过渡态B形成中间体C,C经四元环交叉复分解得到产物4a,由此构成催化循环。
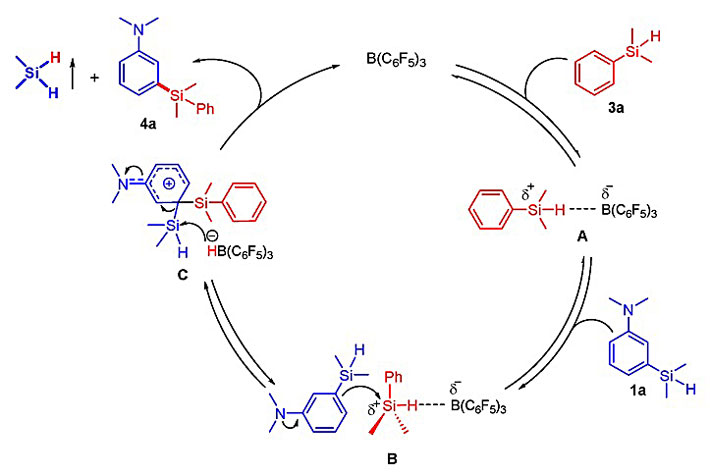
图7. 可能的反应机理。图片来源:J. Am. Chem. Soc.
——总结——
侯召民课题组报道了利用富电子芳香烃取代的氢化硅烷作为底物,首次在硼催化剂B(C6F5)3的作用下实现一系列氢化硅烷的选择性C-Si/Si-H键的自身或交叉复分解反应,并提出了可能的反应机理。该方法反应操作简单,且具有良好的化学选择性和底物适用性,是合成多取代硅烷的新途径,在有机合成化学和材料化学中具有潜在的应用价值。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

B(C6F5)3-Catalyzed C–Si/Si–H Cross-Metathesis of Hydrosilanes
J. Am. Chem. Soc., 2017, 139, 12434, DOI: 10.1021/jacs.7b08053
导师介绍
侯召民
http://www.x-mol.com/university/faculty/31089
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号