中国有机合成化学家的攀登(一) :三萜类天然产物全合成
(题记:本文作者系北大杨震教授的博士毕业生,曾是三萜类天然产物全合成工作重要成员之一,现在继续从事海洋天然产物全合成及药物合成工作。)
合成是化学的核心,而有机合成则又是有机化学的核心,这一似乎有些夸张的提法恰好表达了合成化学的重要意义。从哲学角度讲, 合成不仅是认识世界的一种重要手段, 更是人类改造世界和创造全新物质世界的专门学科。另一方面, 合成化学对工农业生产、发展经济、提高社会生产力等都起到了不可替代的重要作用,有机合成化学尤其是复杂天然全合成的水平更是一个有机化学系所是否强大的重要标志。
十年前,一些重要分子的全合成基本都被美国和日本垄断,中国有机合成化学家在著名刊物上发表的高水平全合成文章少之又少。而如今,一大批中国的有机合成精英已在世界有机合成舞台上绽放光彩,某些领域已经走在世界前列,为国内同行传输了正能量,令国内有机化学同行们备受鼓舞。X-MOL将为大家陆续盘点中国科学家的精彩工作。
本文将为大家带来的是中国科学家在五味子三萜降三萜类天然产物全合成方面的突破。

五味子(Schisandraceae)是一类重要的药用植物,最早列于《神农本草经》上品中药,具有消炎、保护及增强心脏机能、滋补和增强肾脏机能、益气强肝、增进视力、提高记忆力等功效。五味子科植物在我国广泛分布, 已发现21 种可供药用,在云南,有18种五味子科植物在民间作药用, 其药用部位大多为藤茎, 主要用于疏经活络、驱风除湿等。
五味子科植物一直都倍受天然产物化学家的青睐,从2003年开始,中科院昆明植物研究所孙汉董院士课题组针对5种五味子科五味子属药用植物:小花五味子(Schisandra micrantha)、狭叶五味子(Schisandra lancifolia)、滇翼梗五味子(Schisandra henryu)、复瓣黄龙藤(Schisandra plena)和华中五味子(Schisandra sphenanthera)茎藤的化学成分和生物活性进行了系统的研究,分离出了以Micrandilactone A为首的近百个结构类似的降三萜类天然产物。

Sun, H. D.; et al. Nat. Prod. Rep. 2008, 25, 871.
由于独特新颖的化学结构和显著的生物活性,这些极具挑战的复杂天然产物分子引起了一大批有机合成化学家的关注,而近十年来,国外的课题组都只是完成了一些模型研究,前几例的全合成都为国内有机合成化学家完成,分别是北京大学的杨震教授、中国科学院上海有机所的李昂研究员、南开大学的汤平平教授。而这也是迄今为止,全球范围内的几例首次全合成报道。在五味子三萜降三萜类天然产物全合成方面,中国有机合成化学家无疑已经走在了世界前列。令人不禁感慨“十年磨一剑,霜刃未曾试,今日把示君,谁有不平事?”
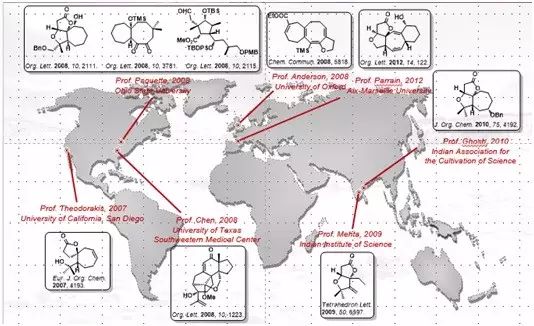
杨震教授的工作
从2005年开始,北京大学化学院杨震教授课题组就开始了对于五味子三萜降三萜类天然产物全合成研究。2005年首先报道了对于右边FGH三环体系的模型研究,其中以该课题组发展的硫脲-钴催化的Pauson-Khand反应和硫脲-钯催化的羰基插入成环反应为关键步骤。

Tang, Y.; Zhang, Y.; Dai, M.; Luo. T.; Deng, L.; Chen, J.; Yang, Z. Org. Lett. 2005, 7, 885.
2006年报道了对于左边ABC三环体系的构建,其中以Diels-Alder反应、串联的HWE/Michael/Lactonization反应和烯炔复分解反应为关键步骤。
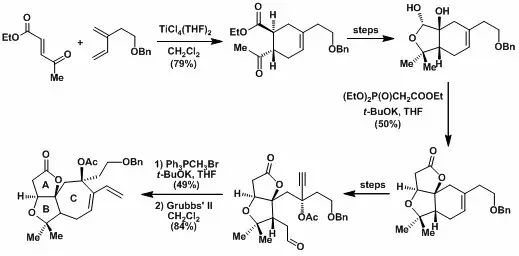
Zhang, Y.; Tang, Y.; Luo, T.; Shen, J.; Chen, J.; Yang, Z. Org. Lett. 2006, 8, 107.
2008年杨震课题组又报道了对于降三萜类天然产物中核心7-8环系的构建,其中以Claisen重排反应为关键步骤实现了具有挑战性的八元环的合成。
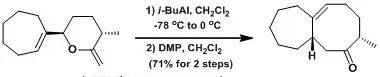
Zhang, Y.; Yang, Z. et al Org. Lett. 2008, 10, 665.
在简单体系中,运用Claisen重排反应高效构建了八元环,但在较复杂体系中,同样条件下并不能发生[3,3]重排反应,而是发生了[1,3]重排反应,并未得到7-8并环。为了合成工作的继续,必须发展新的构建八元环的方法,杨震课题组最终运用经典的RCM反应构建了带有氧桥的八元环,再沿用之前模型中的策略,通过Pauson-Khand反应和羰基插入成环反应构建了FGH环系,至此,该家族天然产物中的CDEFGH六环体系已成功构建,这也为该家族天然产物多样性合成打下了坚实的基础。杨震课题组也于2011年报道了该家族天然产物Schindilactone A的首例全合成,这一工作也被《Angew. Chem. Int. Ed.》选为当期的封面文章。而其中的艰辛和挫折在三篇Full Paper都有体现,这三篇Full Paper也被选为《Chem. Asian J.》的VIP文章。

1) Angew. Chem. Int. Ed., 2011, 50, 7195; 2) Chem. Asian J., 2012, 7, 2321;
3) Chem. Asian J., 2012, 7, 2334; 4) Chem. Asian J., 2012, 7, 2341
作者从简单原料出发,以分子间的Diels-Alder反应作为起始步骤,通过环丙烷化扩环反应、钯催化的偶联反应、烯烃关环复分解反应(RCM反应)、TMTU/Co2(CO)8催化的分子内Pauson-Khand反应、Thiourea/Pd(OAc)2催化的羰基插入成环反应以及Dieckmann缩合反应等一系列关键反应实现了目标分子中核心骨架的构建。分子中的立体化学都是通过底物构象进行了巧妙控制,在简捷高效的基础上还将该实验室发展的基于硫脲体系的方法学成功应用于复杂天然产物的全合成中。最终以29步反应完成了Schindilactone A的首例全合成,这也是该家族天然产物的首例全合成报道。
在这条针对降三萜类天然产物的普适性合成路线中,经过不断的探索和反复的优化,一些关键反应的产率都达到了较好水平,并能大量的制备。更重要的是,从其中的一些关键中间体出发,经由不同的官能团化,则可以合成结构相近的一系列天然产物,这为实现该家族天然产物多样性合成打下了坚实的基础。近期,杨震课题组在《JACS》上报道了该家族另一天然产物Propindilactone G的不对称全合成。而该家族其它天然产物仍在继续合成研究中。
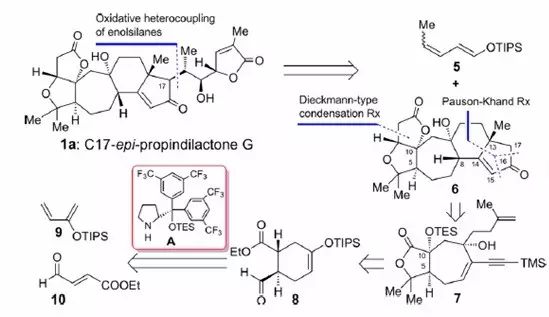
J. Am. Chem. Soc. 2015, 137, 10120−10123
作者仍然从Diels-Alder反应出发,以不对称Diels-Alder反应为起始步骤,引入前两个手性中心,再通过环丙烷化扩环反应、钯催化的偶联反应、分子内Pauson-Khand反应构建了多取代了7-6-5环系,接着Dieckmann缩合反应装上A环,氧化偶联反应引入侧链,最后双羟化反应并内酯化反应以20步完成了全合成。
李昂研究员的工作
2014年,中国科学院上海有机所李昂课题组也在《JACS》上发表了对于降三萜类天然产物Rubriflordilactone A的全合成研究。作者沿用了杨震课题组对于该家族天然产物中ABC三环的构建策略,以不对称Diels-Alder反应为起始步骤,以6Π电环化反应构建了中间的多取代苯环,以Mukaiyama Aldol反应引入侧链,完成了Rubriflordilactone A的不对称全合成,这也是该家族天然产物的第一例不对称全合成研究。
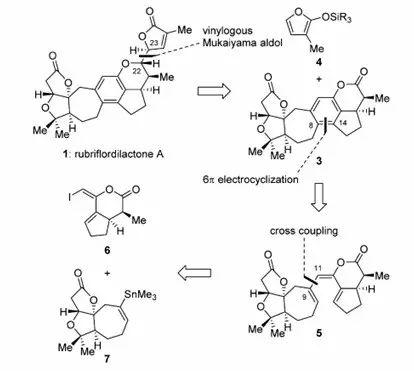
J. Am. Chem. Soc.2014, 136, 16477−16480
汤平平教授的工作
同样在2014年,南开大学的汤平平课题组也在《Angew. Chem. Int. Ed.》上报道了该家族另外两个天然产物Schilancitrilactones B和C的全合成,作者从手性原料香芹酮出发,以分子内Aldol反应和自由基环化反应构建了其中的七元环,并在合成后期通过碘化反应引入碘,并发生分子间自由基加成反应引入侧链,最长线性步骤17步完成了两个天然产物的全合成。
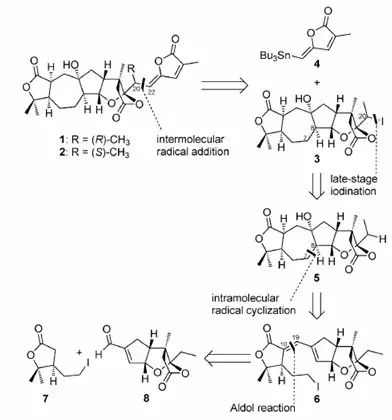
Angew. Chem. Int. Ed.2015, 54, 5732–5735
总之, 近10年来中国有机合成化学家在天然产物全合成这一科学高峰的攀登中不断探索、勇于创新,并能矢志不渝地坚持,凭着巧妙的合成设计以及刻苦努力取得了很大的进展, 缩小了与国际先进水平的差距,并在某些领域已开始引领世界,值得我们骄傲!也让国内同行备受鼓舞!让我们这些有机化学工作者们也全力以赴,加入到有机化学创业的伟大事业中,为祖国的有机化学创新贡献力量吧。
(作者:普天同庆)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号