UTSA刘爱民教授(Feradical)金属蛋白研究实验室近年来工作进展
刘爱民教授Aimin Liu(Feradical)现就职于美国德克萨斯大学圣安东尼奥分校(UTSA),任职终身杰出讲席教授。刘爱民教授研究团队致力于探索生物分子如何利用金属来执行生命所需的化学反应,特别关注初级代谢和次级代谢中的氨基酸以及天然产物的生物合成。通过蛋白质中氨基酸残基的侧链交联,实现分子重塑,达到形成蛋白质辅因子的目标。该团队研究领域涵盖酶学机理、化学生物学、生物无机化学和生物物理学等广泛学科。具体研究方向包括氨基酸代谢、金属蛋白氧活化机制、C–H/C–F键功能化、天然产物生物合成、蛋白质辅因子生物合成、自由基酶学以及金属蛋白介导的信号转导和基因调控。研究方法包括小分子探针合成、各种化学和生物物理技术,如电子顺磁共振(EPR)、电子核双共振光谱(ENDOR)、激光拉曼共振光谱、LC-MS质谱、等温滴定量热法、快速淬灭动力学、蛋白质X射线晶体学,以及引入特定非天然氨基酸到蛋白质特定位点等方法。本文简单概述刘爱民教授研究团队近年来的主要研究成果。
课题组网站:https://Feradical.utsa.edu
电子邮件:Feradical@utsa.edu

刘爱民教授(Feradical)研究团队
(一)概念性贡献
1. 氧化还原调节器——含铁蛋白Pirin
2013年,刘爱民教授(Feradical)实验室发现了一种具有突破性意义的氧化还原感知机制,该机制通过细胞核中名为Pirin的含铁蛋白启动免疫/炎症响应。Pirin在所有人类细胞中都有表达,该团队发现该含铁蛋白是人体最后一道氧化还原防御的调节器。具体来说,Pirin利用铁氧化还原状态介导的结构开关来感知细胞核中的氧化还原爆发,并激活NF-κB信号通路(PNAS, 2013, 110, 9722-9727)。此发现突破了传统的基于硫醇基的感应和响应机制,提出由生物无机化学和结构化学催化的快速氧化还原感知机制调节转录因子NF-κB,这是感染时免疫响应的最后手段。此发现揭示了一种新的天然氧化还原感应和调节策略,提供了更多应对氧化还原应激或损伤的途径。该研究的第一作者Fange Liu博士已在2018年被宾夕法尼亚大学聘为教授,独立开展研究工作。

2. 生物电荷共振
在二血红素酶MauG的研究过程中,该实验室发现并首次提出了生物电荷共振(biological charge resonance, BCR)稳定现象,该现象在近红外区域展现出独特的光谱特征。这一发现首次发表在2013年六月的PNAS(PNAS, 2013, 110, 9639-9644),并在2015年的一篇Angew. Chem.论文中得到进一步验证和阐述(Angew. Chem. Int. Ed., 2015, 54, 3692-3696)。此后,许多系统中类似的BCR现象被其他实验室所证实,强调了其广泛意义。该实验室现在正在深入研究BCR在更多生物过程中的应用,包括生物转化和分子催化过程中关键中间体的稳定。

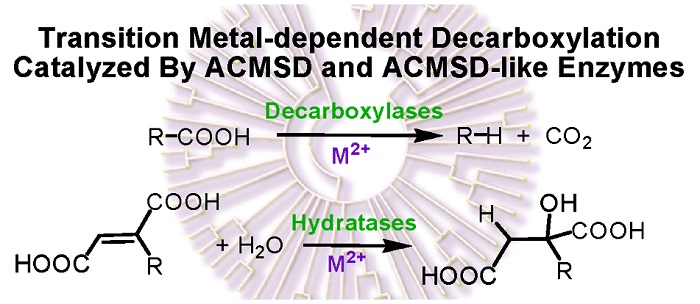
3. 新型生物脱羧形式
该实验室发现了一种新型的生物脱羧形式,即金属依赖且双氧独立的非氧化脱羧酶催化反应。这一发现的原始工作发表在J. Am. Chem. Soc.杂志(J. Am. Chem. Soc., 2005, 127, 12282–12290),并应邀作为“New Concepts in Biochemistry”发表在Biochemistry 杂志新概念专栏(Biochemistry, 2006, 45, 10407-10411)。随后,在酰胺水解酶原始超家族中发现了大量的脱羧酶和水合酶亚家族以及一个新的蛋白质家族。他们的工作纠正了许多错误注释的基因,后来也陆续被其他实验室所验证。
4. 金属酶催化中的电荷维持
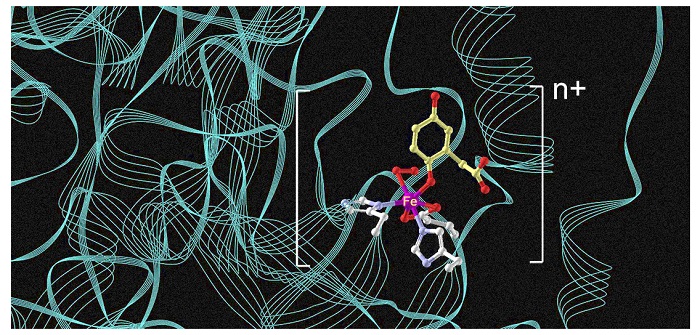
该实验室在2022年引入并详细阐述了金属酶催化中的电荷维持概念,为基于金属酶的O2活化提供了新的视角与见解(ACS Catal., 2022, 12, 6191-6208)。这一概念建立在Lipscomb及其同事早先提出的非血红素铁酶催化过程中的现有电荷维持假设之上,对于理解金属酶机制和氧活化机制至关重要。
(二)发现金属酶底物反应中间体
刘爱民教授(Feradical)实验室在二血红素酶中发现了一种高价双铁 bis-Fe(IV)中间体,揭示了一种在两个不同中心储存两种氧化当量的新型天然策略(PNAS, 2008, 105, 8597-8600)。这种高价铁物质在化学上与常见的铁氧卟啉自由基(即生物化学中所谓的“Compound I”)相当,但它具有更优秀的固有稳定性和对预期蛋白质底物的特异性。由于正电荷和氧化能力分布在两个离散的血红素中心,几乎跨越了大半个蛋白质,这种中间体具有长寿命,同时仍可保持其氧化还原能力,等待合适的底物加载以发生反应。这种金属酶反应中间体可被视为远程催化的天然“狙击手”,为理解酶介导的远程催化提供了新的见解(J. Biol. Inorg. Chem., 2014, 19, 1057-1067)。

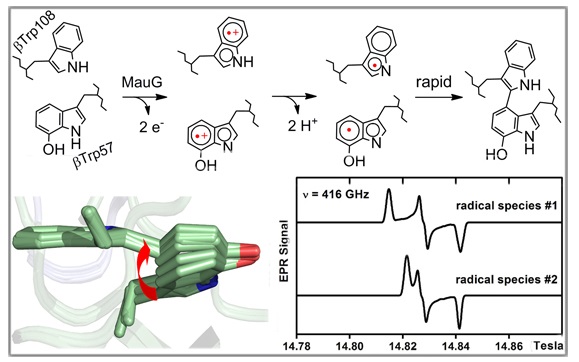
该实验室2013年发现了一种位于色氨酸残基和相邻的7-羟基色氨酸残基上的蛋白质基双自由基(di-radical)中间体(PNAS, 2013, 110, 4569-4573)。这种基于二色氨酸的双自由基以及7-OH-Trp自由基,都是首次被报道。这一发现对于理解生物转化中的自由基化学,特别是涉及两个自由基、依次形成并通过距离转移进行偶联反应的化学过程,具有重要意义。
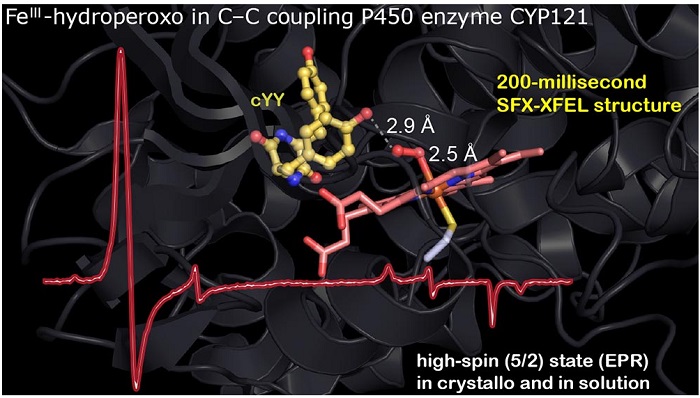
2021年,该实验室直接捕获了酪氨酸羟化酶 (TyrH) 中与结合底物反应中生成的卟啉 Compound 0 中间体(J. Am. Chem. Soc. 2021, 143, 4680-4693)。卟啉Compound 0被认为参与所有血红素催化的氧化还原反应,但此前研究者从未直接观察到它的结构,先前所有Compound 0中间体结构都是通过氧-亚铁配合物的冷冻射线分解还原获得的。值得一提的是,该研究的第一作者Yifan Wang在2021年博士毕业时直接被佐治亚大学聘为助理教授。2017年,该研究团队还曾发现另一个功能更强大的高自旋Compound 0,具体来说,他们在结核分枝杆菌 P450 酶 CYP121 中发现了第一个高自旋 (S = 5/2) 卟啉Compound 0中间体(J. Biol. Chem., 2017, 292, 13645-13657)。最近,他们还成功确定了其结构(J. Am. Chem. Soc., 2023, 145, 25120–25133)。不仅如此,他们与劳伦斯伯克利国家实验室合作开发并改进了一种用于蛋白质晶体内反应的毫秒级快速混合方法,实现了室温下直接测定毫秒时间段反应中间体晶体结构的技术突破,从而直接捕获并测定了血红素 Fe(III)-OOH的分子结构。这些成果深入探究了血红素化学,为基于底物的替代氧化提供了新的策略和见解。
(三)发现新的金属酶活性和催化机理
2018年,刘爱民教授(Feradical)实验室发现了由含铁双加氧酶催化的芳香烃C-H和C-F键裂解机理,这一发现首次发表于Nature Chemical Biology(Nat. Chem. Biol., 2018, 14, 853-860)之后,很快扩展到了其它含铁酶体系(ACS Catal., 2019, 9, 4764-4776; J. Am. Chem. Soc., 2021, 143, 4680-4693),以及含铜酶体系例如半乳糖氧化酶(J. Am. Chem. Soc., 2020, 142, 18753-18757)。这些研究揭示了一种全新的天然绿色化学方法和催化机理,可用于裂解被认为难以断裂的碳氟键。对于重新审视含氟药物安全性和重新评估含氟药物的药物化学设计,以及环境修复领域去除氟污染,这一发现具有重要意义并已引起了广泛关注。

近期,该实验室发现和定义一个新的金属酶家族——血红素依赖性芳香加氧酶(heme-dependent aromatic oxygenase, HDAO)超家族(PNAS, 2021, 118, e2106561118)。这些酶利用组氨酸配位的血红素催化芳香族底物的氧化和加氧,其神奇的能力堪比声名显赫的细胞色素P450酶、过氧化物酶和过氧歧化酶,为生物体中的血红素化学打开了一扇全新的大门。该实验室还发现了P450酶催化的先羟基化再去甲基化(O-demethylation)过程,并通过表征中间体确定其机制(ACS Catal., 2020, 10, 1628-1639)。这些研究成果让我们得以一窥血红素化学的奇妙世界,看到了金属酶丰富多彩的底物氧化策略和适应能力。

(四)新的催化辅因子
刘爱民教授(Feradical)实验室2021年报道了他们发现的一种新型血红素催化辅因子,它既不是常见的B型血红素也不是C型血红素,而是介于两者之间,在半胱氨酸-乙烯基键中具有单个硫醚键。这种辅因子在其蛋白质序列中有一个不寻常的HxnHxxxC氨基酸序列(Chem. Sci., 2021, 12, 3984-3998)。该实验室还发现了C-X-X-C-G-Xn-C-P-X-C-G金属结合基序存在于超过74,071个非冗余蛋白质序列中,起到铁库(iron reservoir)的功能(J. Biol. Chem., 2015, 290, 15621-15634)。该金属结合基序在2,000多种已测定的蛋白质结构中存在,但此前都被认为功能不明而被忽视。这一工作有助于人们增加对于生物铁的获取和储存的理解。
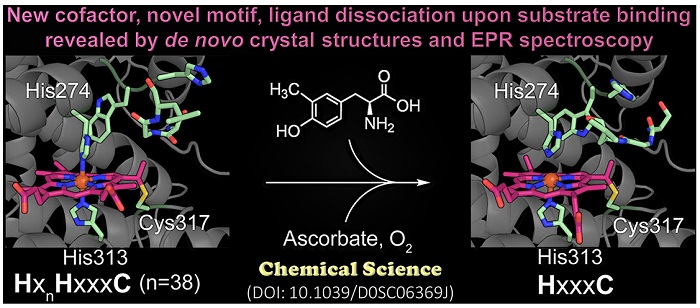
(五)犬尿氨酸分解代谢途径:结构、机制和调节
刘爱民教授(Feradical)实验室在揭示色氨酸代谢途径(又称犬尿氨酸途径)相关的结构和机制方面做出了诸多深入研究,硕果累累,是这一重要代谢途径研究领域的领军者。2018年,该实验室发现了犬尿氨酸通路中“缺失”的脱氢酶基因。此种人脱氢酶先前被其他研究者错误地定义为视黄醛脱氢酶,这是它和通路中后续几个酶缺失的原因(J. Biol. Chem., 2018, 293, 9594-9603)。另外,该实验室2005年就报道了犬尿氨酸途径脱羧酶中的过渡金属辅因子,而在他们的工作之前,人们长期认为这种酶不含辅因子(J. Am. Chem. Soc., 2005, 127, 12282–12290)。这些发现对理解色氨酸代谢起到了积极作用。
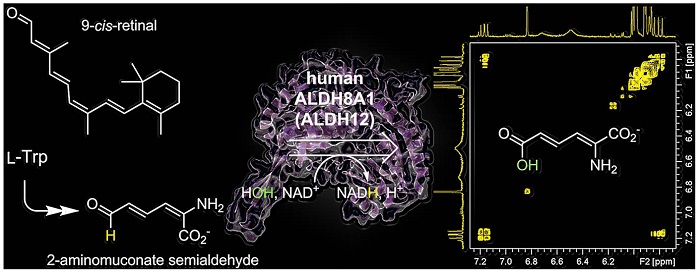
2017年,该实验室在一项临床-基础科学合作研究中发现了一种新的遗传病——高色氨酸血症,并明晰了其色氨酸双加氧酶突变的分子原理(Mol. Genet. Metab., 2017, 120, 317-324)。更重要的是,癌症细胞过度表达色氨酸双加氧酶以逃避免疫,这一发现为征服此类癌症细胞提供了一种新的策略。2020年,通过捕获并在结构和光谱学上确定七种催化中间体(其中五种是在双氧底物到达铁中心之后),该实验室使得犬尿氨酸途径的非血红素铁双加氧酶成为研究理解最彻底的分子氧活化酶(PNAS, 2020, 117, 19720-19730)。此外,通过捕获和表征第一个硫代半缩醛中间体结构以及二元和三元酶-底物复合物结构和酶促反应的后续硫酰基中间体结构,该团队对犬尿氨酸途径的脱氢酶进行了彻底的研究(Nat. Commun., 2015, 6:5935)。2018年,该实验室发现一种有意思的双加氧酶作用机制,该酶利用蛋白质结构动力学变化来容纳两种具有不同极性的底物从而实现底物活化(J. Biol. Chem., 2018, 293, 293, 10415-10424)。这一发现看似寻常,实则意义重大。这是因为我们身处分子氧环境,大多数生物转化过程都涉及亲水性底物与疏水性分子氧之间的反应。这项研究揭示了酶如何适应分子氧,以及如何容纳两种极性差异巨大的底物进行快速催化反应。

在两个独立的案例中,该实验室发现了Fe(II)酶从底物诱导的休眠Fe(III)态再激活的机制,其中一个(色氨酸双加氧酶)解开了困扰学界80多年的谜团(J. Biol. Chem., 2011, 286, 26541-26554; J. Biol. Chem., 2020, 295, 11789-11802)。先前令人困惑的是,当铁处于+3氧化态时,通过添加氧化剂而非还原剂,变成了+2还原态,这似乎与一般的氧化还原化学概念相悖。然而,该实验室研究发现,上述反应在酶底物的存在下才会发生,酶底物充当还原剂;铁离子首先被氧化剂氧化为高价态,然后被底物还原为二价铁离子。

该实验室还首次用晶体学方法巧妙地证明了紧密结合的蛋白质二聚体可以动态解离和重新结合,蛋白质四级结构作为调节酶催化活性的手段。通常认为,蛋白质的四级结构是稳定的,亚基不会轻易解离。该研究团队的结果表明亚基会不断发生动态解离和重新结合,仿佛永不停息地跳着分解和重聚的“探戈”。这一过程通过具有两个催化关键精氨酸残基的脱羧酶实现,其中一个来自其相邻亚基,二者任何一个的突变都会导致没有活性的蛋白质变体。而该团队发现两个无活性精氨酸单突变体的混合物具有催化活性。他们确定了该单突变体混合物的晶体结构,并证明了异二聚体的形成,其中一个亚基具有完整的活性位点,而另一个亚基具有双突变(J. Biol. Chem., 2013, 288, 30862-30871; J. Biol. Chem., 2019, 294, 11609-11621)。
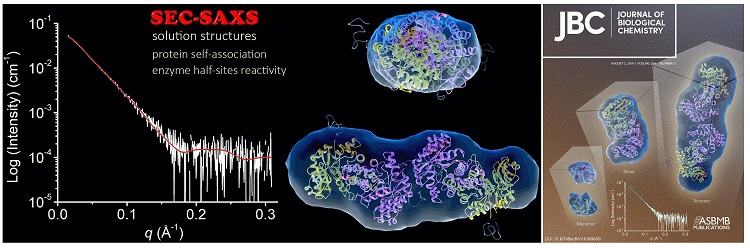
结语
刘爱民教授(Feradical)实验室就像一艘探索分子奥秘的探测船,在化学和生物学的海洋中致力于分子水平上的研究,并在阐释酶促反应机制和蛋白质结构-功能关系方面取得了突破性进展,为战胜疾病开辟了新的航线。值得一提的是,就像前面提到的两位论文第一作者,从这个实验室走出的每一位博士毕业生都成为其职业发展道路上的佼佼者,这也体现了该实验室对科学人才的培养成就。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






























 京公网安备 11010802027423号
京公网安备 11010802027423号