郑大桑鹏教授和USF蔡健峰教授Chem Soc Rev:近年来非天然螺旋拟肽的发展及应用
天然蛋白质具有多种多样的结构和功能,这激发了官能化肽的设计,由于其典型的折叠结构(例如α-螺旋、β-折叠),官能化肽在化学、生物、医学和材料科学等领域发挥着越来越重要的作用。他们在宿主防御肽的模拟、疾病相关的蛋白-蛋白相互作用、催化、分子识别和超分子设计中被发现具有广泛的应用。然而,传统的螺旋肽往往存在二级结构丢失、易被蛋白水解降解以及难以穿透细胞等问题,从而严重限制了其应用。1996年,Seebach和Gellman小组分别独立报道了β-肽的二级螺旋结构(Fig. 1),Gellman于1998年创造了“折叠体”一词。此后,几种不同种类的螺旋折叠体陆续被开发出来。非天然螺旋肽折叠体可以在不同水平上模拟天然α-螺旋的结构和功能,并能克服官能化的常规螺旋肽在生物医学应用中的局限性。
作为传统α-螺旋的替代品,近年来越来越多的非天然螺旋肽折叠体(Fig. 1)进入人们的视野,如β-肽、类肽、低聚脲、α-氨氧基肽、氮杂肽、芳香寡酰胺、γ -肽、磺基-γ-A肽等。与传统的α-螺旋肽不同,非天然螺旋肽折叠体通常由非天然氨基酸组成,并具有明确的折叠倾向和精确的结构参数。非天然主链和模块化合成赋予了螺旋肽折叠体独特的优势,包括对蛋白水解降解优异的抵抗性、增强的生物利用度、改善的化学多样性和模拟蛋白质螺旋片段的普适性。
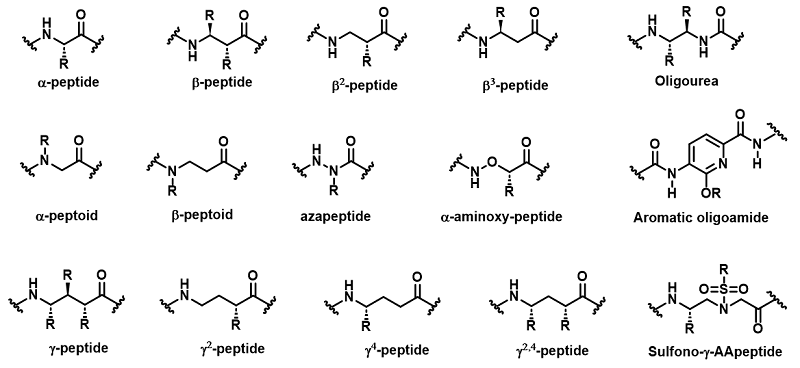
Fig. 1. Structure of α-peptide residue and examples of unnatural helical peptidic foldamer residues
尽管非天然螺旋肽折叠体折叠成可预测、明确、牢固的螺旋结构,且其螺旋参数不同于传统的α螺旋,但在大多数情况下,其螺旋结构的形成仍然像传统的螺旋肽一样在很大程度上依赖于分子内氢键。当然,对于特定的非天然螺旋肽折叠体系统,盐桥、阳离子-π相互作用、π-π相互作用和构象刚性化等也可能单独或组合起主导作用。
基于对非天然螺旋肽折叠体形成的内在力的理解,我们可以认识到组装成螺旋折叠体的最基本单元(非天然氨基酸结构单元)的设计或发现至关重要。目前研究人员开发的非天然氨基酸包括N-取代甘氨酸、N-取代-β-丙氨酸、β-氨基酸、尿素、α-氨基氧酸、α-氨基异丁酸、氮杂氨基酸、芳香酰胺、γ -氨基酸、磺基-γ-AA氨基酸等(Fig. 1)。正是这些模块被以不同的形式设计组合,才获得具有各种功能的所需非天然螺旋肽折叠体。

Fig. 2. Helical L-sulfono-γ-AApeptides. (A) Chemical structures of 13, 14, 15 and 16; (B) Crystal structures of 13 (CCDC: 1841094), 14 (CCDC: 1841091), 15 (CCDC: 1841092) and 16 (CCDC: 1841093).
磺基-γ-AA肽(Fig. 2)由蔡健峰教授课题组独立设计,于2015年首次报道。磺基-γ-AA结构单元源自γ-手性PNA(肽核酸),与传统的二肽残基相,并包含与常规二肽相同数量的侧链。在磺基-γ-AA氨基酸单元中,一个侧链源自经典氨基酸的手性基团,而另一侧链由磺酰氯引入,提供了巨大的化学多样性。他们最近解析了一系列均质的L-磺基-γ-AA肽折叠体的X射线晶体结构(Fig. 2),这些折叠体形成了前所未有的龙舟形和意想不到的左手14螺旋氢键模式。这些磺基-γ-AA肽的螺旋性通过分子内氢键和分子主链上磺酰胺基部分的转角曲率来稳定,从而增强折叠倾向。事实上,磺基-γ-AA肽的折叠似乎是持久的,与侧链无关。有趣的是,这些同质的L-磺基-γ-AA 肽的螺距为5.1 Å(α螺旋为5.4 Å),每圈恰好有四个侧链,并且侧链沿着螺旋轴完美地在顶部对齐。螺旋的旋向由侧链的手性控制,例如,同质D-磺基-γ-AA肽形成右旋螺旋结构,而其镜像螺旋结构由L-磺基-γ-AA肽形成。

Fig. 3. Chemical and crystal structures of representative 1:1 L-α/L-sulfono-γ-AApeptides 31 (A and B, CCDC: 1541641) and 32 (A and C, CCDC: 1946119), and 1:1 D-α/D-sulfono-γ-AApeptide 33 (A and D, CCDC: 1976024).
他们最近还报道了1:1 α/磺基-γ-AA 肽形成的牢固的风车形13螺旋结构,其中磺酰胺基团和分子内氢键诱导了主链的螺旋构象(Fig. 3)。 1:1 α/磺基-γ-AA肽折叠体的螺旋旋向由其手性侧链的手性控制,与非手性磺酰基侧链无关。例如,1:1 L-α/L-磺基-γ-AA 杂化折叠体表现出右旋13螺旋模式(Fig. 3),而 1:1 D-α/D-磺基-γ-AA 杂化折叠体表现出右旋13螺旋模式(Fig. 3)。值得注意的是,这两种折叠体的外消旋体形成异手性卷曲螺旋状二聚体,类似于以两个相反方向的齿轮的方式啮合在一起。更有趣的是,1:1 L-α/L-磺基-γ-AA杂化折叠体通过二聚,形成稳定的拟肽拉链,具有独特的三级结构。3D自组装是由分子内/间氢键和C―Cl―Cl―C卤素键驱动的。
在这篇论文中,作者也简要的概述了过去10年来基于其他非天然拟肽开发的蛋白质螺旋片段模拟,重点关注其原理、结构设计、内在折叠特性的一般特征。作者特别举例说明了非天然螺旋拟肽在蛋白质片段模拟中的应用,包括阻断疾病相关的蛋白质相互作用,催化化学反应,作为生物材料等等。最后,作者也对发展非天然螺旋拟肽面临的当前的挑战和未来的前景做出了分析和展望。
这篇论文有助于引导广大读者了解现有非天然螺旋肽折叠体在蛋白质片段模拟中的结构设计原理和应用,吸引更多的研究人员探索和发现具有独特结构和性质的新型非天然肽折叠体,从而进一步发现非天然螺旋肽折叠体在调节蛋白质-蛋白质相互作用,人工蛋白质的应用,以期未来能够在生物医药,化学催化和新兴材料等方向有所贡献。
该论文最近在Chemical Society Reviews 在线发表,郑州大学桑鹏教授和南佛罗里达大学(USF)蔡健峰教授为文章的共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Unnatural helical peptidic foldamers as protein segment mimics
Peng Sang * and Jianfeng Cai *
Chem. Soc. Rev., 2023, DOI: 10.1039/D2CS00395C
课题组主页
蔡健峰
http://jianfengcai.myweb.usf.edu/
https://www.x-mol.com/university/faculty/47852
桑鹏
https://www.x-mol.com/groups/Sang_peng
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






























 京公网安备 11010802027423号
京公网安备 11010802027423号