Garg课题组Nat. Chem.:芳炔环化策略,(–)-Tubingensin B首次全合成
结构复杂的吲哚生物碱一直以来都是全合成领域的明(è)星(mèng),不断“逼迫”化学家们绞尽脑汁地创造新的化学转化方法和合成策略。Tubingensin B这种吲哚双萜类化合物也是其中一员,该天然产物于1989年从塔宾曲霉(Aspergillus tubingensis)中分离而得,绝对构型于同年通过X射线单晶衍射确定。Tubingensin B是次级代谢产物,具有抗虫、抗癌及抗病毒活性,在农用化学品以及药物领域具有潜在的应用价值。
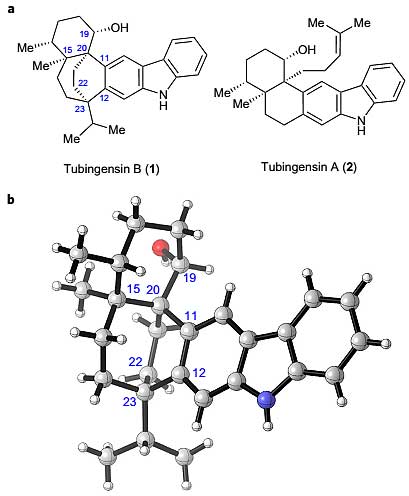
图1. Tubingensin B和A结构。图片来源:Nat. Chem.
Tubingensin B的结构看似简单,但两个相邻的C(sp2)-C(sp3)键以及与咔唑相连的两个季碳手性中心都是合成的难点,更为挑战的是与咔唑稠合的双环-[3.2.2]-壬烷和高度官能化的六元环部分。该天然产物共含有5个手性中心,其中3个是季碳中心,而且有2个季碳中心还相邻(图1a)。尽管已有两篇关于相关天然产物Tubingensin A的全合成报道,然而到目前为止Tubingensin B的全合成尚无报道,由此可见其合成的复杂性和难度。近期,来自美国加州大学洛杉矶分校(UCLA)的化学家Neil K. Garg教授(点击查看介绍)及其团队在Nature Chemistry 发表论文,利用高活性的芳炔中间体构建复杂产物的策略对Tubingensin B进行了高效全合成。

Neil Garg教授。图片来源:UCLA
作者首先对Tubingensin B进行了逆合成分析,其中C22–C23键可通过自由基环化反应来构建,同时可组装得到双环-[3.2.2]-壬烷骨架和C23季碳中心。接下来是逆合成分析中的关键,中间体3可通过咔唑芳炔(中间体4)环化来实现。咔唑芳炔中间体4可通过烯醇硅醚中间体5的C20官能化来实现(芳炔形成和烯醇捕获)。中间体5可由两个相对简单的片段6和7来合成(图2)。
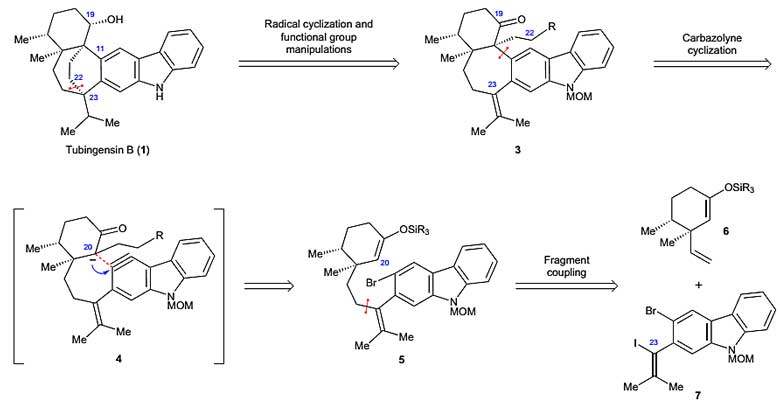
图2. Tubingensin B的逆合成分析。图片来源:Nat. Chem.
作者首先对偶联片段7和四取代烯烃13进行合成。中间体8(三步合成)首先在Pd(PPh3)4/CuI催化下进行Sonogashira偶联,以84%的产率得到中间体9,随后进行碳金属化/碘代反应,以71%的产率得到碘代醇10,最终碘代醇10再经过两步脱氧反应得到烯基碘中间体7。化合物11(四步合成)与9-BBN进行经典的硼氢化反应得到烷基硼试剂12,在Pd2(dba)3/AsPh3的催化体系下与中间体7进行Suzuki反应,以73%的产率得到中间体13。在合成中间体13的过程中有几点值得注意:(1)AsPh3配体对Suzuki反应至关重要;(2)芳基溴参与的偶联竞争反应没有发生;(3)DMIPS(二甲基异丙基硅醚)能很好地兼容偶联条件;(4)通过C(sp2)–C(sp3)键偶联来构建四取代烯烃并不常见(图3)。
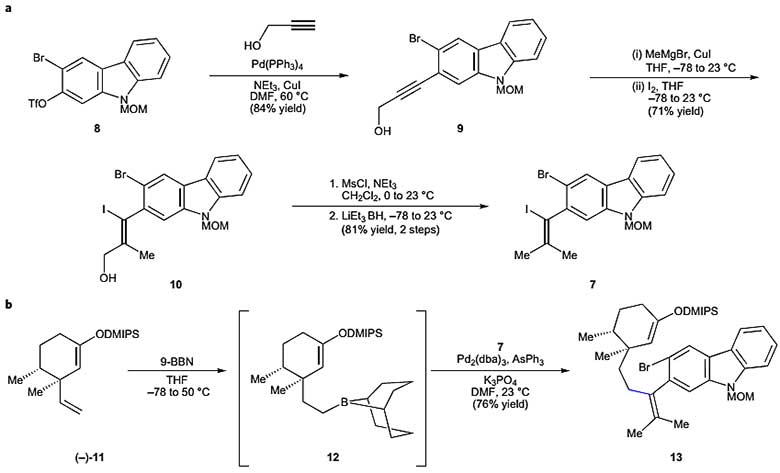
图3. 偶联片段7和四取代烯烃13的合成。图片来源:Nat. Chem.
作者接下来进行了芳炔环化的研究。为了得到芳炔环化的原料,首先要经过三步反应在C20位置引入氧取代的两碳单元。中间体13通过两步Eschenmoser亚甲基化反应得到不饱和酮中间体14,与原位产生的有机铜试剂进行共轭加成反应,再使用TESCl对烯醇中间体进行捕获得到C20官能化的烯醇硅醚15。作者根据以往构建6,6-稠环的经验,认为中间体15在氨基钠/叔丁醇的作用下于室温条件可以形成烯醇,接着消除溴化氢,最后进行芳炔环化构建中环,然而在该条件下得到的主要产物却是[2+2]环化的产物16。作者并没有因此放弃,继续探索合成目标中间体的方法,最终发现在碱性条件下,温度提高到60 ℃时能以高非对映选择性和58%的产率构建七元环和含有相邻季碳手性中心的中间体17(图4)。
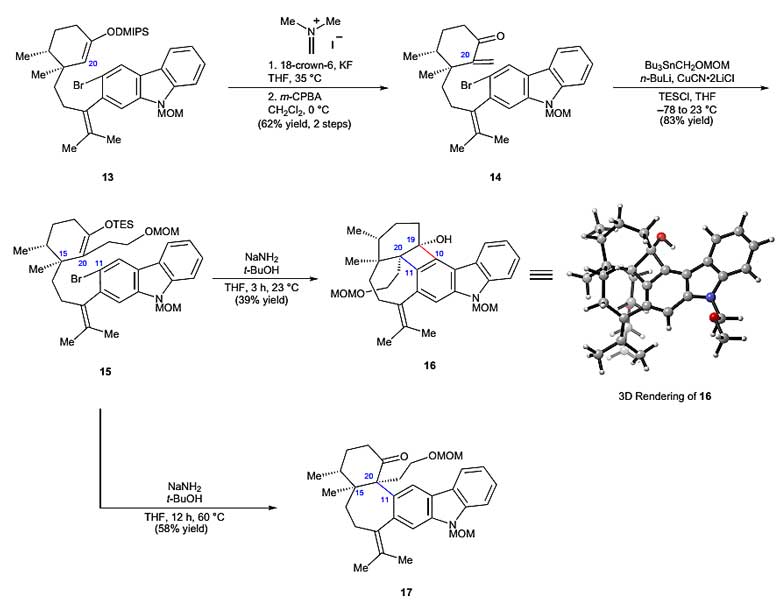
图4. 关键的芳炔环化构建C20–C11键。图片来源:Nat. Chem.
得到中间体17后,下一个目标是进行自由基环化和最终产物的合成。首先中间体17进行羰基还原后羟基进行硅烷保护得到中间体18,然而不幸的是中间体17还原时专一性地发生在17的α-面,作者在尝试筛选还原剂进行立体构型的反转时均以失败告终,因而C19的立体构型在合成后期还需要进一步纠正。随后中间体18经过脱MOM保护基和Appel反应得到中间体19。令人欣喜的是,中间体19在Bu3SnH/AIBN条件下顺利发生自由基环化反应,以89%的产率得到桥连的双环化合物中间体20。接下来他们需要对C19的构型进行纠正,中间体20经过简单的脱硅烷保护基/氧化/脱MOM保护基三步反应得到中间体21。当尝试还原中间体21时,尽管他们做出诸多努力,得到的却全是天然产物C19的异构体,尝试通过Mitsunobu反应反转C19的手性也没有成功。随后,作者尝试催化剂调控的策略,当使用(S )-Ru(OAc)2(BINAP)催化剂催化氢化时以定量的产率得到还原产物,尽管Tubingensin B和epi-Tubingensin B的比例为1:4,但该反应还是得到了天然产物Tubingensin B的第一个合成样品(图5)。
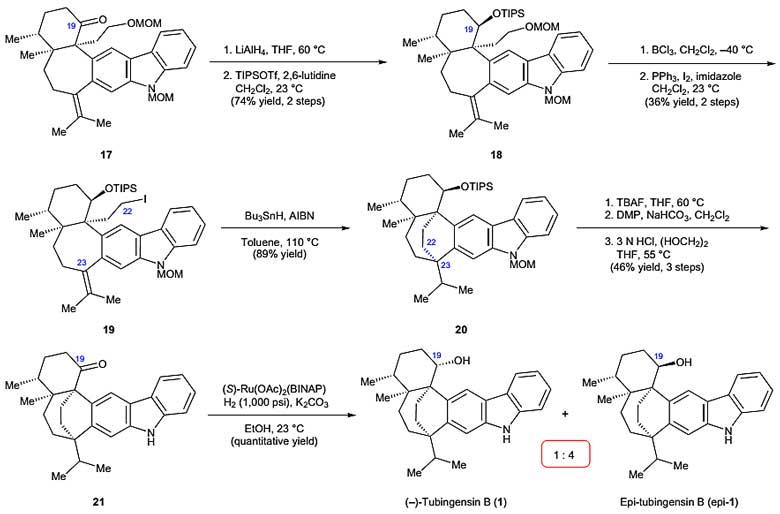
图5. Tubingensin B的一代全合成。图片来源:Nat. Chem.
Tubingensin B的顺利合成证实了逆合成分析中关键步骤的可靠性,作者随后尝试使全合成路线更加简洁线性。他们认为理想情况下最后合成阶段应该避免关于C19酮和将MOM保护的醇转化为自由基环化前体等繁琐的操作,在总结失败的原因后,作者成功实现了这一目标。中间体14在CuCN•2LiCl与TESCl的存在下与苯硒基甲基锂发生反应得到中间体22。在合成中间体23的过程中,作者尝试60 ℃加热条件来避免环丁醇形成时却发现苯硒基化合物的分解,作者随后在室温条件下进行反应,成功以47%的产率得到单一构型中间体23。为了切断C10-C19键,作者使用Murakami等人发展的Rh催化开环反应策略,以53%的产率顺利得到中间体24。中间体24再经过自由基环化和脱MOM保护基两步反应得到中间体21。作者对最后一步羰基还原反应进行了一系列催化剂筛选,最终(S )-Ru(OAc)2(DMSEGPHOS)催化体系能以接近1:1的比例得到Tubingensin B和epi-Tubingensin B(图6)。考虑到epi-Tubingensin B可通过简单的氧化得到中间体21以及合成方法的简洁性,该方法还是可以作为解决C19立体中心的可行方法。合成产物和天然产物的表征数据对比也证实了该全合成得以成功完成。
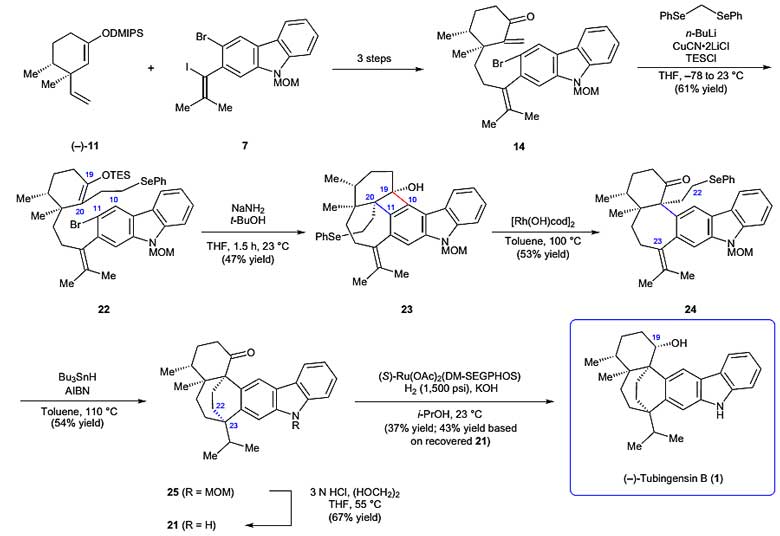
图6. Tubingensin B的简洁全合成。图片来源:Nat. Chem.
——总结——
Neil Garg教授团队成功进行了(–)-Tubingensin B的全合成工作,芳炔环化是整个合成过程的关键步骤。作者对第一代合成路线进行了分析和改进,从而开发出更加简洁高效的线性合成方法。可以预见,这种芳炔环化策略有希望应用于构建多种复杂结构,例如相邻的季碳手性中心。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Total synthesis of (–)-tubingensin B enabled by the strategic use of an aryne cyclization
Nature Chem., 2017, DOI: 10.1038/nchem.2801
导师介绍
Neil Garg
http://www.x-mol.com/university/faculty/835
课题组主页
http://www.chem.ucla.edu/dept/Faculty/garg/Garg_Group/Home.html
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号