他山之石,可以攻玉!生物物理,挖宝利器!
生物物理学技术在当今科研生产领域有着非常广泛的应用,涉及到的学科更是包括了化学、生物学、材料学、药学等等多学科门类。应用生物物理学技术往往能从另一个角度突破原有专业知识局限挖到意想不到的宝贝。本君一直从事新药发现相关研究,但是长期以来受困于活性化合物的靶标寻找与确认。药靶确认是新药发现过程中的一个重要环节。特别是对于多靶点作用的天然产物以及基于表型筛选得到的各种活性化合物,确认药靶成为了活性化合物和临床候选药物之间一道难以逾越的鸿沟。以往,这部分工作更多依赖于各种生物化学方法。近几年,大量生物物理学技术手段被广泛应用于活性化合物的靶标确认环节,这在某种程度上加速了新药开发的速度,也为更多活性天然产物的成药开发扫清了关键技术屏障。随着自己对各种生物物理学技术的了解和应用,深感其在药靶确认环节中大有用武之地。今天,就为大家介绍药靶确认环节中使用较为广泛的几种生物物理学技术,算是端午节的福利吧。

药“靶”确认是新药发现的重要环节。图片来自网络
1. X-Ray Crystallography
众所周知,X-射线单晶衍射技术在表征化合物结构中具有举足轻重的作用。对于生物分子的结构解析,X-射线晶体学(XRC)同样占据重要地位。在药物研发过程中,活性化合物与生物分子复合物的共结晶(简称共晶)结构解析无疑成为了活性化合物药靶确认的强有力武器。
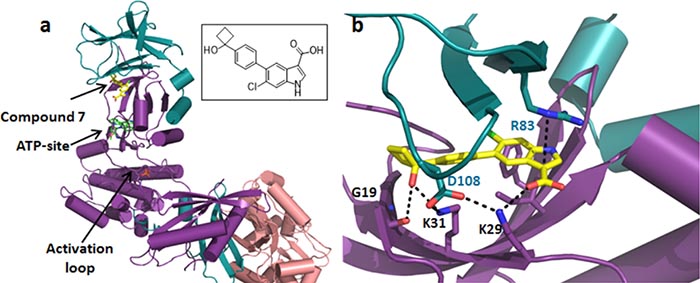
有机小分子与蛋白质的共晶实验。图片来源:J. Med. Chem.
优势:能明确化合物关键片段与生物分子直接相互作用的具体结合位点信息,这是其他技术所不能提供的。精确到原子级别的相互作用信息可以称得上是药物化学家手中的利剑。
局限:被研究的生物分子要能够很好地结晶,并且能获得化合物与生物分子的共晶。无法对相互作用强度进行相对定量。整个研究过程需要大量的生物分子,且实验周期较长。
2. NMR (Nuclear magnetic resonance)
用于研究小分子有机化合物和生物大分子相互作用的核磁共振(NMR)技术有许多,比如STD-NMR,Water-LOGSY,1H/13C-HSQC,1H/15N-HSQC等等。总的来说,可以分为两大流派。一派是通过大分子NMR信号变化确认相互作用形式(1H/13C-HSQC,1H/15N-HSQC等),另一派则是通过检测小分子NMR信号变化确认相互作用形式(如STD-NMR,Water-LOGSY等)。
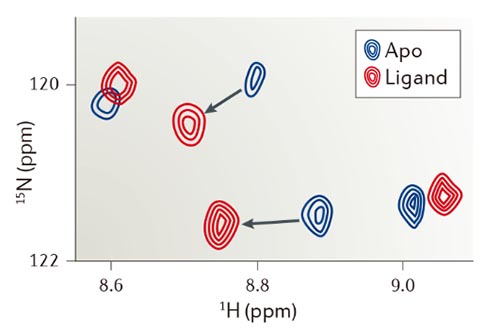
2D 1H/15N HSQC NMR。图片来源:Nat. Rev. Drug. Discov.
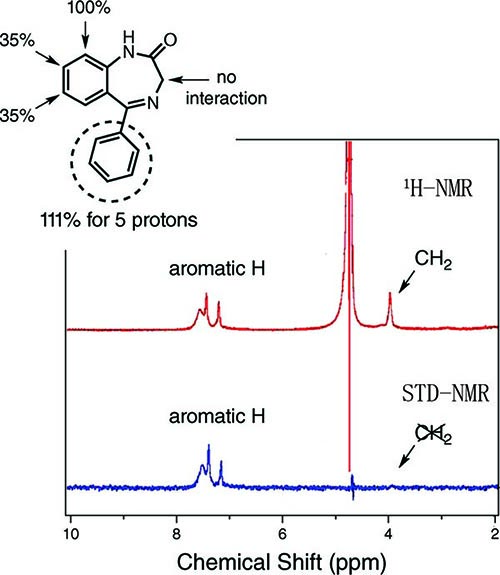
STD-NMR分析人血清白蛋白和硝西泮类似物。图片来源:J. Chem. Educ.
优势:基于大分子的NMR检测能解析出生物大分子的结构,通过滴定实验计算出小分子与生物大分子结合强度Kd值;基于小分子的NMR检测能明确小分子哪个结构片段与生物大分子存在相互作用,对生物分子的大小无要求,更不需要对其进行同位素标记。
局限:基于大分子的NMR检测大多需要对蛋白进行大量13C和(或)15N的同位素标记,通常适用于分子量小于40 kDa的小蛋白;基于小分子的NMR检测有时则会受制于小分子的结构而无法应用。
3. SPR (surface plasmon resonance)
如果说上述两项技术是在研究小分子结构信息的基础上拓展而来,那么表面等离子共振(SPR)技术似乎就是为研究大分子而生,该技术在研究生物大分子之间相互作用领域中有着不俗表现。就目前发展而言,检测小分子与生物大分子的SPR技术也可分为两种流派:一派是基于微流体表面感受器的检测技术(固定生物大分子);另一派是基于微阵列感受器靠CCD相机成像的检测技术(固定小分子化合物库)。
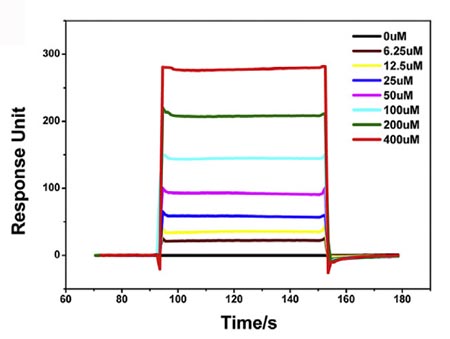
基于微流体表面感受器的SPR实验。图片来源:Cell
基于微阵列感受器的SPR实验。图片来源:Nat. Rev. Drug. Discov.
优势:基于微流体表面感受器的SPR技术可以直接进行和时间相关的各种检测,比如测定Kd,kon,koff的具体数值;基于微阵列感受器的SPR技术则具有超高通量的优势,无论哪种SPR技术,它们都可以进行化学计量学研究(也就是一个靶点结合几个活性化合物),并且灵敏度都非常高足以满足目前各种常规检测。
局限:第一种SPR技术需要固定生物分子到芯片上,固定过程中会导致部分失活,对于一些稳定性较差的生物分子难以应用这种方法;第二种SPR技术需要固定化合物库到感受器上因此需要对化合物进行特定的共价修饰。
4. ITC (Isothermal titration calorimetry)
等温滴定量热(ITC)技术能够测量生物分子与配体之间相互作用时的热量改变。因其能测得分子间相互作用的各种热力学常数(ΔH,ΔS,ΔCP),Kd值以及化学计量学结果被许多科研人员奉为验证分子间直接相互作用的“金标准”。

ITC实验结果。图片来源:J. Med. Chem.
优势:生物大分子和化合物均不需要任何化学修饰,量热过程完全在溶液中进行,实验结果直接反映分子间相互作用热力学情况,结果可靠性高。
局限:生物大分子消耗巨大!巨大!巨大!许多研究人员抱怨滴定小分子与蛋白作用时产热太小…太小…太小……
上述四大技术可称得上是药靶确认过程中应用相对广泛的生物物理学技术。除此之外,还有一些相对小众的技术手段用于确认药靶,比如TSA(Thermal shift analysis)、DSC(Differential scanning calorimetry),质谱技术中的NC‑MS(Non-covalent MS)、AS‑MS(Affinity-selection MS)、HDX‑MS(hydrogen–deuterium exchange MS)等等。由于篇幅所限,就不在这一一列举了。
在药物研发过程中,这些生物物理学技术除了应用于靶标确认,在基于片段的药物发现(fragment-based drug discovery,FBDD)领域更是有着不俗的表现,这方面的报道很多,我也就不在此赘述了。
希望大家通过我的介绍对这些技术有所了解,也许将来再解决某个问题时脑中能闪过一道光影,然后拿出手机找到这篇文章。至少,在读文献时看到上面的类似配图不至于一脸茫然。
最后,欢迎用过上述某个技术的同学积极踊跃留言。毕竟本君水平有限,难免有错漏之处,大家多多交流哦。
参考文献:
1. Biophysics in drug discovery: impact, challenges and opportunities. Nat. Rev. Drug. Discov., 2016, 15, 679-698
2. The Practice of Medicinal Chemistry 3rd.
(本文由乐只君子供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号