美国Merck公司Science:利用多功能催化剂立体选择性构建磷手性中心
编者按:这篇Science论文采用了上海交通大学张万斌团队的手性双环咪唑催化剂骨架,X-MOL也十分有幸就此采访了张万斌教授,采访总结附于文末,供诸君阅览。
提到手性化合物,大家可能马上想到的是手性碳。事实上,除了手性碳,还有手性氮、手性磷、手性硫等等。到目前为止,许多催化转化方法在构建碳手性中心方面已经非常成熟,但要利用类似的方法合成手性磷化合物如磷酸酯或者磷酰胺,并取得高立体选择性,仍然是一个极具挑战性的难题。磷酰胺类药物是治疗病毒性疾病和癌症的关键成分,以往最有效的合成方法需要进行手性拆分或者使用化学计量的手性辅基。因此,发展一种有效的方法高立体选择性地合成手性磷酰胺就显得非常重要。近期,美国Merck公司的Daniel A. DiRocco等人基于上海交通大学张万斌教授的手性双环咪唑骨架设计并合成了一种多功能催化剂,并利用该催化剂高立体选择性、高产率地构建了磷手性中心,得到相应的手性磷酰胺,并将其用于药物研发中。这一结果发表在Science上。
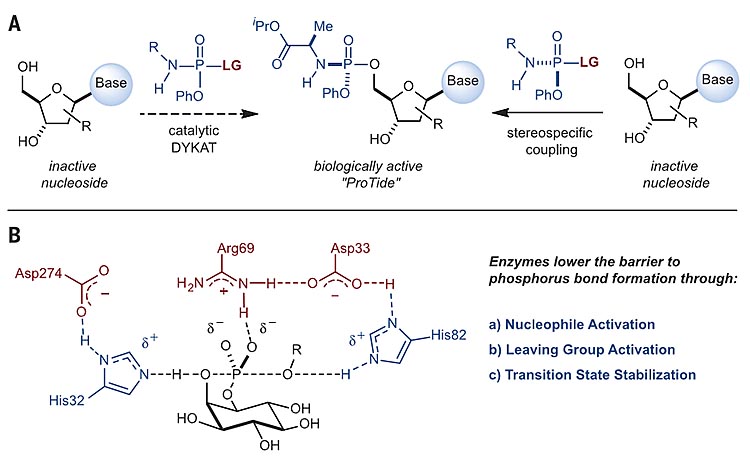
图1. 磷氧键的形成策略。图片来源:Science
体内核苷酸的磷酰化是生物必需的生理活动,但由于三磷酸核苷不稳定以及无效的跨膜转运,并不是理想的药物候选物。而核苷类前药pronucleotide(ProTide)通过引入5'-磷酰基可以明显增加细胞通透性和体内磷酸化率。如图1A所示,以不对称催化的方式合成四价的磷-杂原子键的方法包括前手性底物的去对称化或者动态动力学不对称转化(DYKAT),这些方法目前的局限在于低催化效率和低选择性。除了磷原子中心的立体选择性以外,另一个挑战在于核苷中5'-位和3'-位之间的化学选择性。自然界中,酶可以通过一系列的催化模式进行选择性磷酰化。如图1B所示,在研究磷脂酰肌醇特异性磷脂酶C磷-氧键的形成时,Ryan等人提出了五价的磷过渡态模型,通过氢键的模式同时活化了亲核试剂和离去基团,并对过渡态加以稳定。
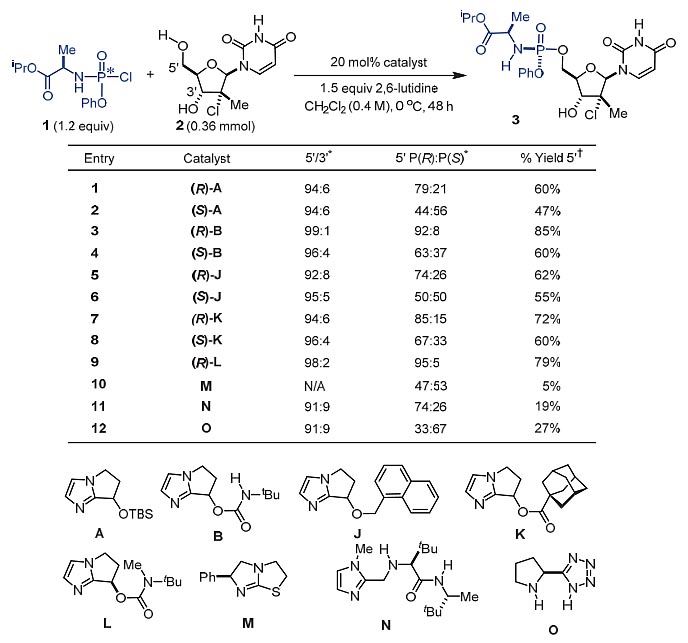
图2. 催化剂的发展。图片来源:Science
作者研究了磷酰氯化合物1与核苷2的反应,以组装成核苷类前药MK-3682(3,图2)。这是一种丙型肝炎病毒(HCV)NS5b病毒的RNA聚合酶抑制剂,目前在临床试验中用于治疗HCV感染。作者首先考察了不同非手性亲核催化剂,以探测反应的立体化学结果。在McGuigan最初报道的条件下[N-甲基咪唑(NMI),2,6-二甲基吡啶],反应以49%的产率得到所需的磷酰化产物,而磷中心R:S构型比例仅为52:48。
2010年,上海交通大学的张万斌教授报道了一种手性双环咪唑类催化剂,该催化剂可以有效催化不对称Steglich重排等反应(J. Am. Chem. Soc., 2010, 132, 15939-15941)。随后他们设想将其应用于酰胺的不对称磷酰化反应中,首次实现了手性磷酰胺类化合物的不对称催化合成,遗憾的是仅得到了中等的对映选择性(ee ~ 40%)。DiRocco等人借鉴这一思路,使用张万斌教授报道的最优催化剂(R )-J催化不对称磷酰化反应,以62%产率和74:26的选择性得到目标产物(图2A,entry 5)。随后作者对其进一步优化,以氨基甲酸酯(R )-B作为催化剂,发现随着催化剂的负载量增加,反应的选择性也相应增加。这表明该反应是一个非一级反应,动力学分析表明反应和催化剂浓度二级相关,和核苷的浓度一级相关。这些数据表明,在反应过程中,磷酰氯底物1先和催化剂作用形成4或者5,再和核苷2作用。从反应的过渡态可以看出,由于氢键存在,形成的手性环境对控制反应的立体选择性具有十分重要的影响。咪唑上的N可以作为碱协助攫取核苷中羟基位的H,起到活化亲核试剂的作用,而咪唑上的H以及苯环上的H会和P=O羰基中的O作用,起到了稳定亲电试剂的作用。除此之外,催化剂本身又是良好的离去基团。理论计算表明,形成R构型的磷手性中心过渡态的能量更有利,比S构型的低2.3 kcal/mol。
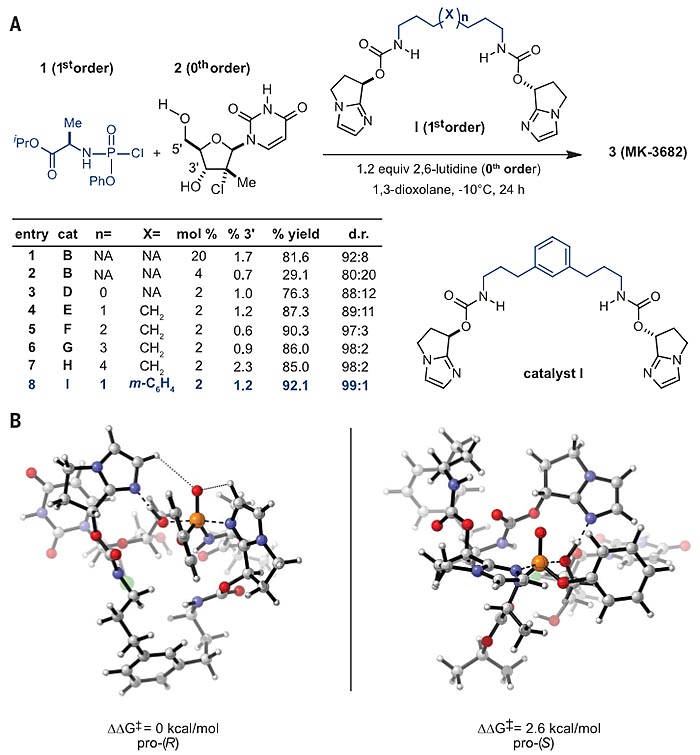
图3. 新型二聚体催化剂的设计。图片来源:Science
随后作者基于手性双环咪唑骨架设计了手性双齿双环咪唑催化剂,并且在Jacobsen工作的启示下(J. Am. Chem. Soc., 1998, 120, 10780-10781),通过不同长度的碳脂肪链对催化剂进行调整,以期通过减少高度有序过渡态的熵减效应来提高催化剂和底物的结合能力,进而提高反应速率与选择性。如图3A所示,当催化剂的中轴使用苯环连接时(即催化剂I),催化效果最佳(entry 8),反应仅使用2 mol%的催化剂就能以92.1%的收率和99:1的选择性得到R构型的磷酰化产物,5'-位和3'-位化学选择性也非常优秀,理论计算结果同样表明,形成R构型的磷手性中心,过渡态能量比S构型的低2.6 kcal/mol。
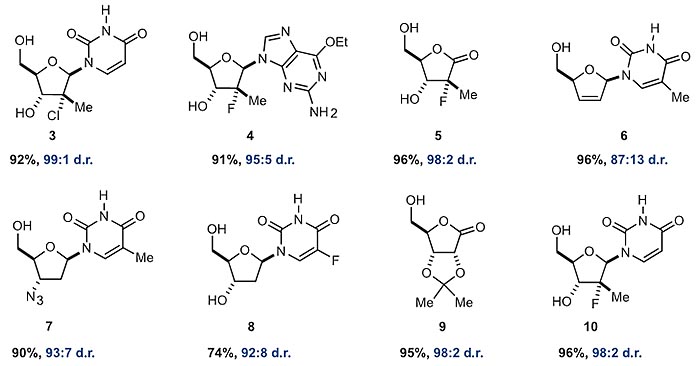
图4. 底物的扩展。图片来源:Science
有了最佳反应条件,作者对底物核苷进行了普适性考察。可以看出,演示的8个底物都取得了优秀的产率和选择性,核苷中的羟基、胺基、叠氮基、卤素、缩酮、内酯等基团都能良好地兼容。
——总结——
美国Merck公司的Daniel A. DiRocco等人在这篇Science 文章中,基于上海交通大学张万斌教授在手性双环咪唑骨架催化剂以及不对称磷酰化方面的工作,设计并合成了一种在该类反应中效果更好的多功能催化剂,高立体选择性、高产率地实现了核苷类底物的不对称磷酰化,并将其用于核苷类前药MK-3682的研发中。该反应条件温和、操作简便、催化剂负载量较低,具有良好的产率和选择性,在磷手性化合物如磷酰胺类前药的合成中都具有非常重要的意义。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A multifunctional catalyst that stereoselectively assembles prodrugs
Science, 2017, 356, 426-430, DOI: 10.1126/science.aam7936
张万斌教授采访
X-MOL:您课题组之前在磷手性化合物方向做了哪些相关工作?
张万斌教授:众所周知,磷手性化合物在医药、农药以及催化剂等领域具有广泛而重要的应用价值。本课题组在2006年提出了利用手性叔胺催化不对称磷酰化反应的想法,并获得了一家日本企业的资助进行手性磷酰胺类农药噻唑磷的高效合成方法开发。在大量实验和分析基础上,我们最终设计合成了一类具有全新结构的手性双环咪唑骨架催化剂,并将其成功地应用于不对称磷酰化反应,实现了手性磷酰胺类化合物的首例不对称催化合成,可惜当时仅获得40%的对映选择性(Tetrahedron Asymmetry, 2012, 23, 329)。经过我们这些年的研究,我们还发现该类双环咪唑骨架催化剂在不对称碳酰化反应如二级醇动力学拆分、Steglich重排、Black重排以及直接碳酰化等反应中均表现出很好的催化效果(J. Am. Chem. Soc., 2010, 132, 15939; Adv. Synth. Catal., 2014, 356, 3164; Chem. Commun., 2014, 50, 1227; Chem. Commun., 2014, 50, 3163; Chem. Commun., 2017, 53, 1381.)。
X-MOL:这篇Science论文采用了您团队的手性双环咪唑催化剂骨架,您对此作何评论?
张万斌教授:我们非常欣喜地看到我们最初的设计思路被美国Merck公司的研究人员采用并进行了进一步的改进。他们利用我们的双环咪唑骨架成功开发了多功能催化剂,实现了高效的立体选择性磷酰化反应,并将其成功应用于一类重要的核苷类前药MK-3682的合成。我们在此真诚地期待手性双环咪唑骨架催化剂可以被应用于更多不对称催化反应中,同时能有更高效的磷手性构建方法被开发出来。
张万斌教授简介:
http://www.x-mol.com/university/faculty/12592
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号