重氮乙酸三氟乙酯芳基高对位选择性C-H键烷基化
芳香烃在自然界、合成领域以及与材料相关的领域广泛存在,实现这一类化合物的高效合成是非常重要的。非活化C-H键的直接官能团化由于可以有效减少化合物合成步骤、提高合成转化的原子经济性,甚至可能实现常规方法难以完成的化学合成,目前已经成为有机化学和可持续发展化学的一个重要基础课题,被称为“化学的圣杯”。其中控制非活化C-H键的区域选择性是关键的挑战。经典的亲电芳香取代(傅克反应)是用于芳基C(sp2)-H键官能团化最普通的方法,但是反应常常得到邻位取代和对位取代产物的混合物。导向基团辅助的策略是解决选择性问题最有效的方法,但是这样的策略主要运用在距离较近的邻位上,很难实现远端如对位C(sp2)-H键官能团化。而且对于一些不含有杂原子的分子(如烷基苯)而言构筑导向基团成为难题。因此,发展单取代芳基高对位选择性的C(sp2)-H键官能化的通用策略是十分必要的。
重氮基化合物作为一种重要的有机合成试剂,在温和的条件下,可以进行一系列化学转化如环丙烷化、Wolff重排、迁移插入、X-H(X= O, S, N, Si, B等)插入、C(sp3)-H官能团化等。其中,通过卡宾转移反应来实现C(sp2)-H键的官能团化,由于其原子经济性和步骤经济性的特点近些年受到了越来越多的关注(Chin. J. Org. Chem., 2017, DOI: 10.6023/cjoc201702020)。但已有的报道表明,烷基取代苯和重氮乙酸酯在过渡金属存在下会发生其它竞争反应,单取代芳香烃苯环的高对位选择性C(sp2)-H官能团化实现起来并不容易。例如:在铁、银和铜等催化剂的作用下,甲苯和重氮乙酸酯可以发生Buchner反应;在铑催化剂催化下,甲苯的苄位能发生C(sp3)–H官能团化;最近,一些关于烷基取代芳烃的C(sp2)–H官能团化相继报道,但是反应产生了烷基邻、间、对位混合的产物。
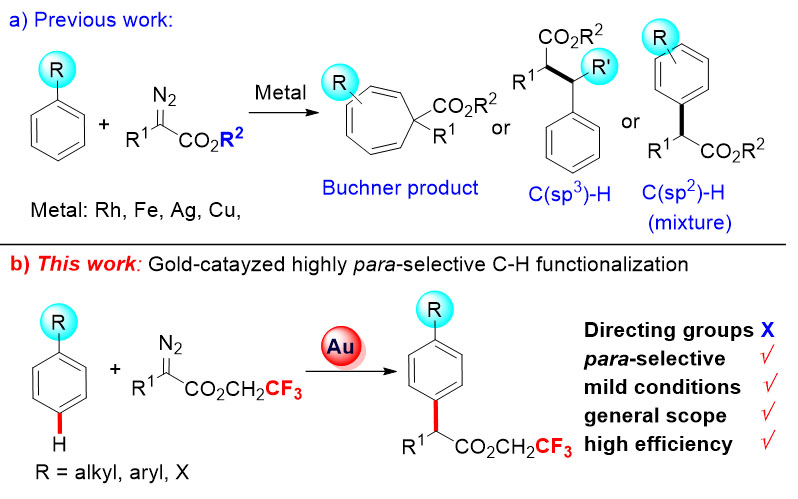
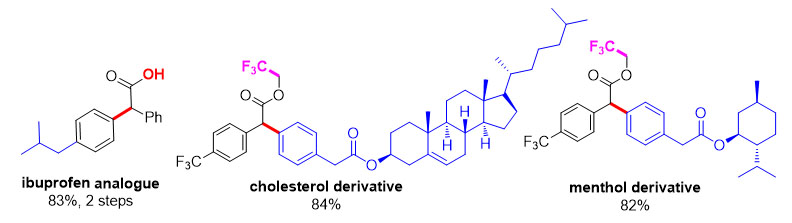
金催化剂由于其特殊的π-酸性和催化活性在有机合成研究中得到了显著进展,但是在重氮基化合物的转化中应用还比较少。近年来的研究表明,金催化剂对芳基的C(sp2)-H官能团化有特殊的活性。华东师范大学化学与分子工程学院刘路教授(点击查看介绍)和张俊良教授(点击查看介绍)课题组近年来致力于金催化剂催化的重氮基化合物对芳基的C(sp2)-H键官能化的研究。在实现了富电子芳香烃高选择性C(sp2)-H键官能团化的基础上(J. Am. Chem. Soc., 2014, 136, 6904-6907;Angew. Chem. Int. Ed., 2016, 55, 14807),使用金络合物为催化剂,同时使用重氮乙酸三氟乙酯为原料,可以有效的实现非活化芳基对位的C(sp2)-H键官能团化。该反应底物普适性良好、条件温和、区域选择性高且催化剂负载量低。反应可以放大到克级规模,在天然产物和药物活性分子的合成(如布洛芬类似物)以及后期修饰(如薄荷醇和胆固醇衍生物)中有着潜在的应用。
这一研究成果发表在《德国应用化学》上,文章第一作者是华东师范大学博士研究生马奔。
该研究工作得到了国家自然科学基金委、上海市青年浦江人才计划的大力支持。目前,该课题组对该课题的延伸还在进一步的研究中。
该论文作者为:Ben Ma, Zhaowei Chu, Ben Huang, Zhenli Liu, Prof. Dr. Lu Liu, Prof. Dr. Junliang Zhang
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Highly para-Selective C−H Alkylation of Benzene Derivatives with 2,2,2-Trifluoroethyl α-Aryl-α-Diazoesters
Angew. Chem. Int. Ed., 2017, 56, 2749-2753, DOI: 10.1002/anie.201611809
导师介绍
刘路
http://www.x-mol.com/university/faculty/26728
张俊良
http://www.x-mol.com/university/faculty/10529
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号