稀土金属催化环丙烯的不对称氢胺化 ——手性氨基环丙烷衍生物的立体选择性构建
众所周知,手性氨基环丙烷衍生物是一类非常重要的有机化合物,如图1所示,这类结构单元广泛存在于具有生物活性的手性天然产物以及药物中。因而开展高效、高立体选择性的途径来合成这类化合物具有非常重要的研究价值。
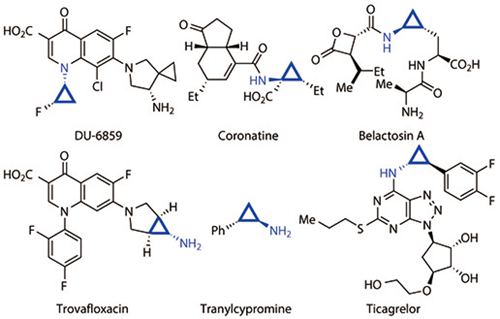
图1. 含氨基环丙烷结构单元的天然产物和药物
另一方面,烯烃的不对称氢胺化是构建天然产物和生物活性分子中含氮杂环结构的有效手段。在过去的几十年中,有机化学家合成了多种手性催化剂来实现该类反应的立体选择性控制,但这些催化剂大多局限于分子内的不对称氢胺化,分子间不对称氢胺化的例子相对较少。日本理化学研究所的侯召民(点击查看介绍)课题组长期致力于单茂稀土烷基化合物的合成及其在烯烃聚合、氢芳基化等反应中的应用。最近,该课题组开发了一系列手性单茂稀土金属烷基化合物(图2),并成功实现了吡啶对末端烯烃的不对称C―H加成反应(J. Am. Chem. Soc., 2014, 136, 12209)。在此工作中,他们又将该催化剂应用于取代环丙烯的不对称氢胺化反应,以100%的原子经济性和99%的立体选择性合成了一系列手性氨基环丙烷衍生物。这一成果发表在《Angew. Chem. Int. Ed.》(Angew. Chem. Int. Ed., 2016, 55, 15406)上。
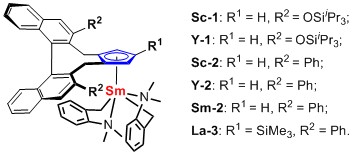
图2. 手性单茂稀土烷基化合物
作者首先以3-甲基-3-苯基环丙烯1a和吗啡啉2a作为模板底物,通过一系列的条件筛选,发现Sm-2是该反应最优的催化剂,反应使用5 mol%的催化剂,以甲苯作为溶剂,在室温下可以顺利进行,最终以95%的收率,>20:1的 dr值和99%的ee 值得到了目标产物3a。
在最佳条件下,作者以吗啡啉2a对各种取代基取代的环丙烯底物的适用性进行了考察。从图3所示的结果可以看出,苯环上间位和对位的取代基对该反应的活性和对映选择性影响较小,均以较高的收率(up to 96%)和立体选择性(up to > 20:1 dr和99% ee)获得相应的氨基环丙烷产物。但邻位氯取代的环丙烯仅给出84%的收率,7:1的dr值和89%的ee 值。1位萘基取代的底物也仅给出了6:1的dr值和84%的ee 值。此外,作者发现环丙烯上两个取代基的位阻大小差异对于该反应的非对映选择性有很大影响,如3o-3q结果所示。
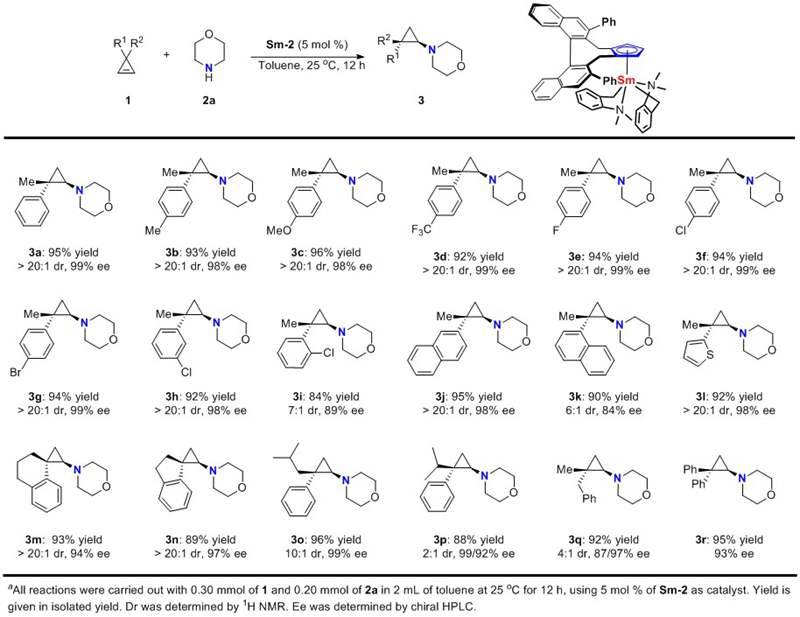
图3. 环丙烯的底物适用性考察
随后作者以3-甲基-3-苯基环丙烯1a为底物对各种胺源进行了考察。代表性结果如图4所示,不同取代基取代的环仲胺都以高收率(88-97%)和高立体选择性(> 20:1 dr和91-99% ee)给出了相应产物4a-4h。而在非环仲胺参与的反应中,La-3给出了最佳结果,如4i-4j所示。最后,作者还考察了伯胺在该反应中的适用性,以5 mol% 的Y-2为催化剂,二苯基甲胺与环丙烯1a反应可以顺利进行,给出了中等的收率(56%)和很好的立体选择性(> 20:1 dr和89% ee)。
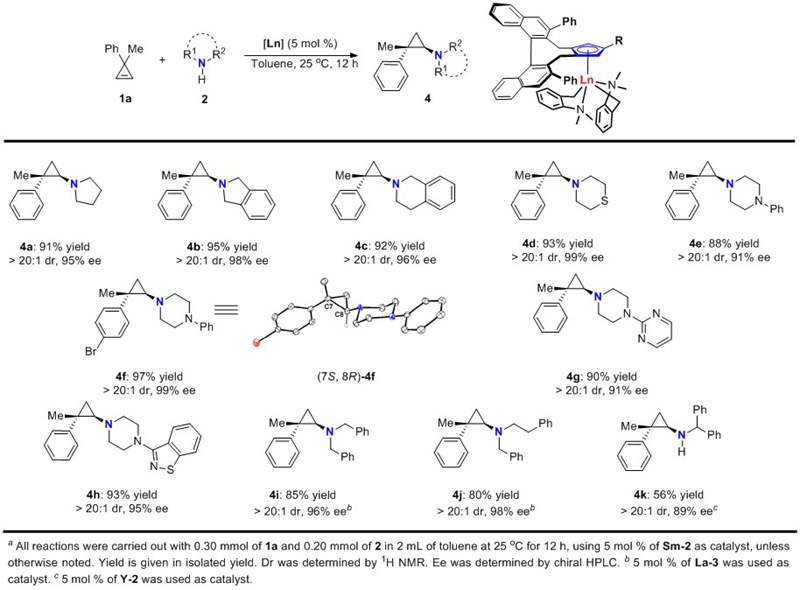
图4. 胺的底物适用范围考察
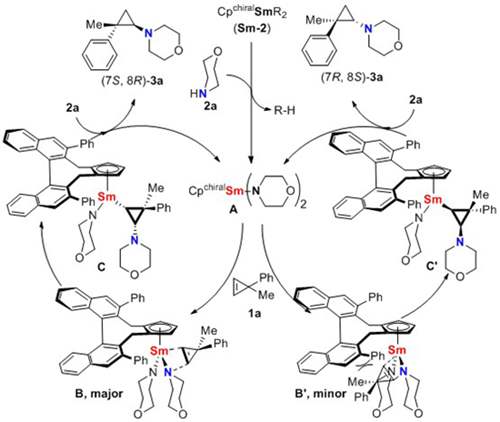
图5.反应机理和催化过渡态
最后,作者提出了如图5中所示的可能反应机理和催化过渡态以解释该反应的立体选择性控制。
小结:侯召民课题组开发了一系列手性单茂稀土金属烷基化合物,并以此实现了环丙烯的不对称氢胺化反应。这一方法为手性氨基环丙烷衍生物的构建提供了一条高效便捷的途径。
该论文作者为:Huai-Long Teng, Yong Luo, Baoli Wang, Liang Zhang, Masayoshi Nishiura and Zhaomin Hou*
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Synthesis of Chiral Aminocyclopropanes by Rare-Earth-Metal-Catalyzed Cyclopropene Hydroamination
Angew. Chem. Int. Ed., 2016, 55, 15406-15410, DOI: 10.1002/anie.201609853
导师介绍
侯召民
http://www.x-mol.com/university/faculty/9030
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号