余金权团队Science:异丙基去对称化,构建α-手性中心
很多小分子药物的核心结构包括至少一个手性中心。通过脂肪族C-H键活化构建手性中心,一直以来都是有机化学家追求的目标。然而,由于惰性脂肪族C-H键活化的难度以及手性控制等问题,该领域一直进展缓慢。美国斯克里普斯研究所(The Scripps Research Institute,TSRI)的余金权(Jin-Quan Yu)教授是C-H键活化领域的知名化学家,过去十数年中他率领的团队在这一领域做出了卓越的贡献,也因此荣获2016年的麦克阿瑟“天才奖”(点击阅读详细)。最近,他的团队又有新突破,他们在Science 上报道了使用手性单保护的胺甲基噁唑啉化合物作配体,在Pd催化条件下实现了酰胺导向的异丁酸衍生物中异丙基的去对称化,通过不对称β-C(sp3)-H官能团化反应构建α-手性中心,芳基化、烯基化、炔基化都能以较高的产率和对映选择性实现(Scheme 1)。余金权课题组博士后武庆锋(Qing-Feng Wu)为论文第一作者。

论文部分作者(从左至右):Ru-yi Zhu、武庆锋、余金权、Peng-Xiang Shen、Qian Shao。
图片来源:Madeline McCurry-Schmidt / TSRI
受酶催化异丁酸C-H键活化构建手性中心历程的启发(Scheme 1A),余金权课题组一直尝试通过过渡金属催化的策略实现该过程(Scheme 1B)。2016年,余金权课题组使用乙酰基保护的胺乙基喹啉配体,实现了亚甲基sp3C-H键的官能团化反应(点击阅读详细)。与亚甲基sp3 C-H键相比,异丙基的不对称去对称化反应则面临着不同的挑战。对中间体I和II进行位阻分析可以更好的了解这种区别:对于亚甲基sp3 C-H键活化来说,需要对大位阻烷基R和亚甲基C-H键进行位阻区分。而对于异丙基的不对称去对称化反应,则需要对相对较小的甲基和α-H进行区分。另外,前手性α-碳原子和催化剂距离太远,这导致异丙基的去对称化反应更加具有挑战。在该工作中,作者使用手性单保护的胺甲基噁唑啉化合物作配体,实现了这一过程(Scheme 1C)。
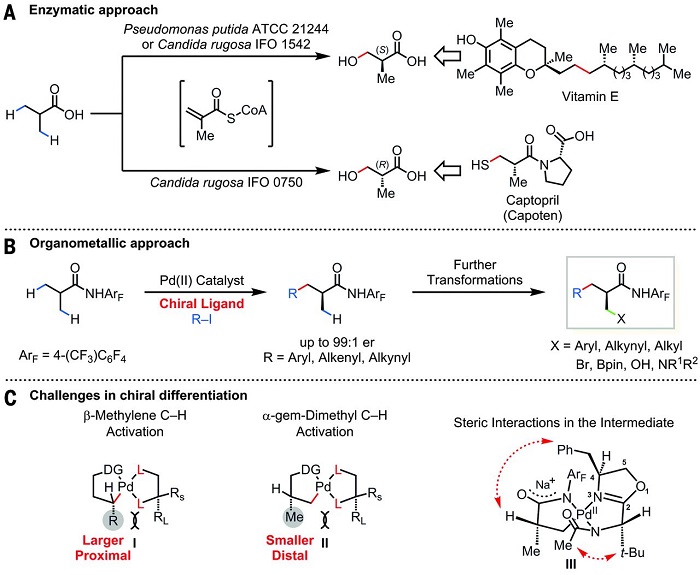
Scheme 1. 通过C-H键活化构建手性中心。A. 酶催化途径;B.金属催化途径;C. 手性区分的挑战。图片来源:Science
在条件优化部分,作者对一系列手性配体进行了筛选,发现在使用L23作配体时,反应以70%的收率和98:2的er值得到目标产物2b(Scheme 2A)。随后,基于L23配体的最优条件,作者对异丁酸衍生物(Scheme 2B)及2-氨基异丁酸衍生物(Scheme 2C)的对映选择性C-H键芳基化的底物范围进行了探究。结果表明,底物的适用范围广,反应产率高,对映选择性较好。多种官能团如F、Cl、NO2、CO2Me等都可以兼容。
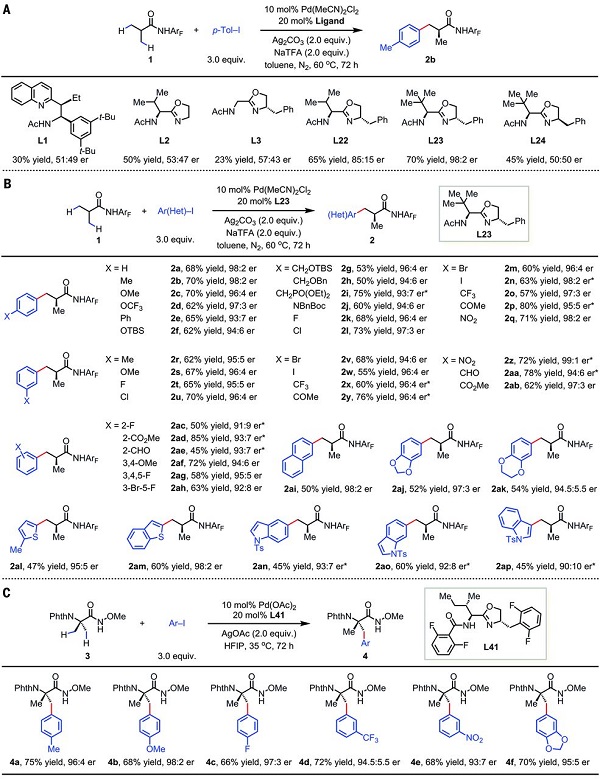
Scheme 2. 异丁酸衍生物及2-氨基异丁酸衍生物的对映选择性C-H键芳基化。A. 配体优化;B. 异丁酸衍生物的芳基化;C. 2-氨基异丁酸衍生物的芳基化。图片来源:Science
研究完芳基化反应后,作者对异丁酸衍生物的对映选择性C-H键烯基化与炔基化的底物适用范围进行了考察(Scheme 3),产率和er值都较为客观。芳基乙烯碘化物(5a-5t)、脂肪族末端烯烃碘化物(5u)、丙烯酸酯类碘化物(5v)、末端炔碘化物(6)都可以较好地参与反应。
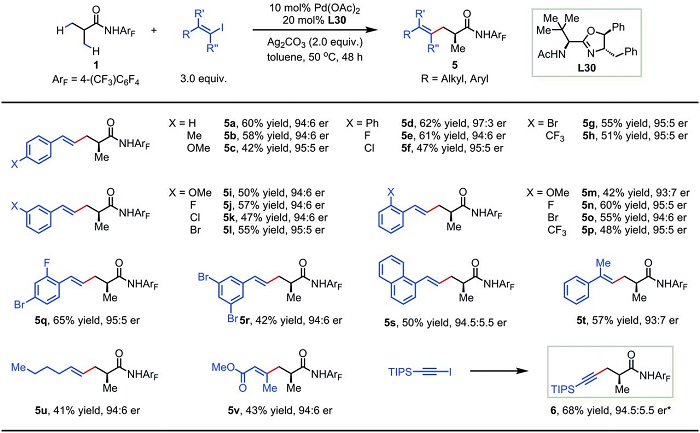
Scheme 3. 异丁酸衍生物的对映选择性C-H键烯基化与炔基化。图片来源:Science
最后,作者使用经一步对映选择性的芳基化产物2a作起始原料,对余下甲基进行多种官能团化反应(Scheme 4,具体条件参考SI)。在特定条件下,芳基化(7a-7f)、炔基化(8)、烷基化(9)、溴化(10)和硼化反应(11)都可以很顺利地进行。而11可以经转化得到胺化(12)和羟基化的产物(13)。
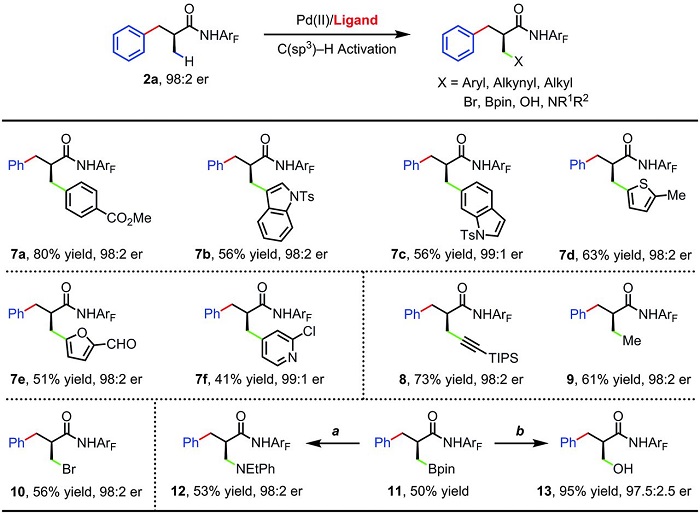
Scheme 4. 余下甲基的多种官能团化反应。图片来源:Science
余金权教授在接受采访时说到,“这一方法从本质上来说是模拟了酶的能力,把简单的有机分子变成手性分子,但是我们的方法能做的更多。”余教授还透露,与他实验室有合作的百时美施贵宝(BMS)的研究人员,已经在用这一方法合成潜在的药物分子了。
—— 总结 ——
在该工作,余金权团队发展了使用手性单保护的胺甲基噁唑啉化合物作配体,在Pd催化条件下实现了酰胺导向的异丁酸及2-氨基异丁酸衍生物中异丙基的不对称去对称化反应,多种官能团化反应,如芳基化、烯基化、炔基化都可以顺利地进行。反应产率高,对映选择性好,官能团兼容性强。并且作者还对芳基化的产物进行了余下甲基C-H键的多种官能化反应,并取得了很好的结果。这一成果为在不对称合成中构建α-手性中心提供了一个颇具通用性的新方法。
原文(扫描二维码,识别后直达原文页面,或点此阅读原文):

Formation of α-chiral centers by asymmetric β-C(sp3)–H arylation, alkenylation, and alkynylation
Science, 2017, 355, 499-503, DOI: 10.1126/science.aal5175
部分内容编译自:
http://www.scripps.edu/news/press/2017/20170202yu.html
(本文由ChemHP供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号