Science:首例蛋白质催化C-Si键的形成,将C-Si键引入生命体成为可能
碳和硅在自然界中有很多种存在形式,但是含有C-Si键或可以催化形成C-Si键的生物分子却至今没有被发现,传统的C-Si键合成的研究在过去的几十年里已经日趋成熟,其中一个典型的不对称手性C-Si键合成方法就是过渡金属催化Si-H键的卡宾插入反应,比较高效的催化剂有铜、铱、铑等,再配合使用手性配体,可以得到几乎纯的对映体。但是这种方法也有一些缺点,像卤代溶剂的使用、低温操作以及有限的转换数等(通常是低于100)。而酶催化通常条件温和、高效且具有选择性,近日加州理工学院(Caltech)的Frances H. Arnold课题组发现了首例可以催化C-Si键形成的蛋白质,通过蛋白质的定向进化,可以催化Si-H键的卡宾插入反应,产物具有近乎完美的立体选择性,这种方法比传统的金属催化剂高效15倍。这项工作也入选了美国化学会C&EN刚刚评选出的“2016年顶级科研成果”(点击阅读详细)。
在此项工作之前,酶催化N-H、S-H键的卡宾插入反应已有过报道,通过蛋白质的定向进化获得了很高的选择性。受此启发,Arnold等人提出可以使用血红素蛋白进行Si-H的卡宾插入反应。底物分别是苯基二甲基硅烷和2-重氮丙酸乙酯,在中性条件室温条件下,作者对一系列血红素蛋白进行了筛选,结果如下图A右,结果显示一种来自冰岛海底温泉的耐高温细菌Rhodothermus marinus的细胞色素C(Rma cyt c)可以催化该反应,并且ee值高达97%,这表明反应发生在一个具有高立体结构特异性的环境中。下图B中显示了野生型Rma cyt c蛋白质的晶体结构,其中heme坐落于一个憎水的空腔,铁离子分别与一个近端的组氨酸(H49)和远端的甲硫氨酸(M100)配位,作者认为甲硫氨酸在配位上是不稳定的,如果将其替换,便很有可能找到一个更高效的C-Si键形成的蛋白质催化剂。
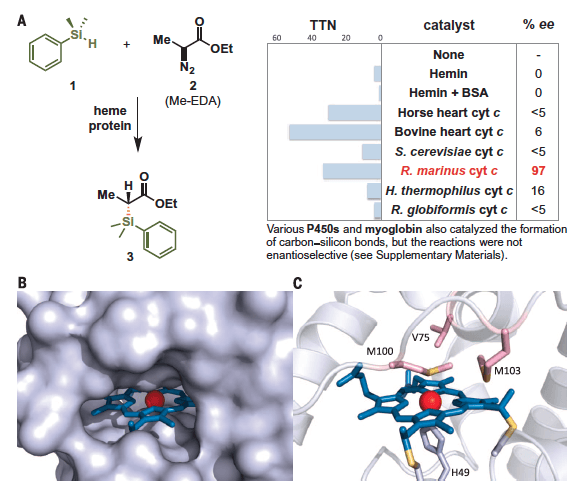
图1. A左) Si-H键插入反应的底物以及产物;右)血红素蛋白催化剂以及相应的反应周转数和反应手性选择性 B) 野生型Rma cyt c蛋白质的surface模型和晶体结构。图片来源:Science
接着作者便通过蛋白质定向进化的方法,形成了三种突变型蛋白M100D、V75T M100D和V75T M100D M103E,并用这三种突变型蛋白进行了上述实验。结果显示,V75T M100D M103E可以将ee值提高到99%,并且转换数高达1500,这比传统的金属催化剂高了15倍多。
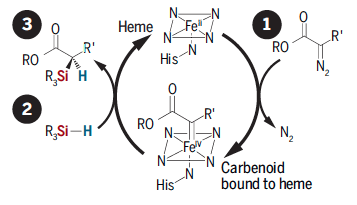
图2. 血红素蛋白催化 Si-H键插入反应的机理。图片来源:Science
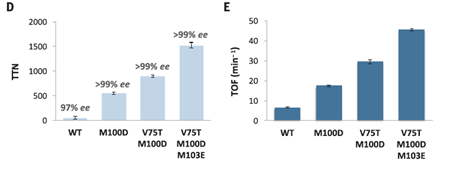
图3. 野生型蛋白和三种突变型蛋白M100D, V75T M100D 和V75T M100D M103E的酶活性。图片来源:Science
更令人咋舌的是,这种蛋白质催化剂可以应用到更多底物中。下图中所有的反应中,作者几乎都能获得纯的单一对映体。
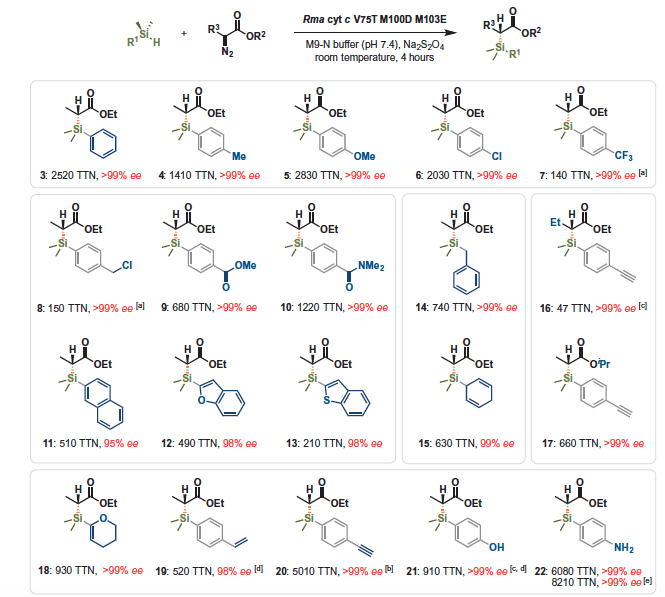
图4. Rma cyt c V75T M100D M103E蛋白质催化C-Si键形成的底物适用性实验。图片来源:Science
—— 总结 ——
文中报道了首例蛋白质催化C-Si键的形成,对蛋白质的简单的突变便可以提高反应的转换数以及手性选择性,并且这种催化剂的适用范围非常广,这一发现拉近了生物催化和化学催化的距离,使得含有C-Si键的生物分子甚至生命体成为可能。
原文(扫描或长按二维码,识别后直达原文页面):

http://science.sciencemag.org/content/354/6315/1048
Directed evolution of cytochrome c for carbon–silicon bond formation: Bringing silicon to life
Science, 2016, 354, 1048-1051, DOI: 10.1126/science.aah6219
(本文由PhillyEM供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号