Nature Chem.:格氏试剂,技能升级
带有氮、氧取代基的芳香环是很多活性药物分子、农用化学品甚至功能材料的主要结构,也是有机合成的重要目标。有机金属试剂在有机合成中的地位非同寻常,以有百年历史并得过诺奖的格氏试剂为例,它们亲核性极强,可以与很多亲电试剂反应形成C-C键,算得上是有机合成化学中最经典的试剂之一。不过,与引入C-C键相比,通过芳基金属试剂形成C-N键、C-O键从而引入氨基或者羟基要困难的多,这主要是由于缺乏有效的氮或氧转移试剂。最近,美国莱斯大学László Kürti(点击查看介绍)和杨百翰大学Daniel H. Ess(点击查看介绍)等人利用他们开发的稳定性良好的氮-氢-氧杂吖丙啶(N-H oxaziridine)和氮-烷基-氧杂吖丙啶(N-alkyl oxaziridine)作为胺基和羟基转移试剂,与上百种芳基格氏试剂反应,实现芳胺和酚类化合物的一步合成。该工作发表在Nature Chemistry 上,第一作者是Kürti课题组的高洪银博士(2011年毕业于华东师范大学,导师为张俊良教授;现为山东大学教授,点击查看介绍)。

高洪银博士(左)、László Kürti教授(中)和Daniel Ess教授(右)。图片来源:Rice University / Brigham Young University
通常构建一级芳基胺的方法主要有:1)芳香硝基化合物的还原;2)过渡金属催化的芳基卤代物与胺化试剂的交叉偶联;3)过渡金属催化的亲电胺化反应;4)芳香亲核取代反应(SNAr)等。而通常构建酚类化合物的方法主要有:1)芳香亲核取代反应(SNAr);2)芳基硼酸及衍生物的氧化;3)金属催化的芳环的氧化等。可以看出,大多数方法都用到了过渡金属或其络合物,这导致了反应条件苛刻、底物适用性受限等缺点。于是,Kürti等作者考虑使用无过渡金属参与的过程,他们把眼光放在了价廉易得的芳基格氏试剂和芳基锂试剂上。不过,过去报道中所使用的芳基金属试剂胺化和羟基化试剂,均有各种局限性(Scheme 1 a-d)。为了解决这些问题,作者们尝试开发新型的胺化和羟基化试剂。
Scheme 1.目前非过渡金属参与的从芳基金属试剂合成芳胺和酚类化合物的研究和本工作的重大发现。图片来源:Nature Chem.
由于N-H的酸性,在位阻较小时,N-H可以与格氏试剂发生质子交换从而淬灭格氏试剂(Scheme 1e)。因此,N-H的旁边需要较大的位阻,降低N-H的动力学酸性(Scheme 1f)。作者考察了底物13,发现在60 ℃下仍然难以发生质子交换,证实了自己的想法。作者希望从有位阻的氮-氢-氧杂吖丙啶出发,抑制质子的转移,得到N-H转移的产物(Scheme 1g)。氧杂吖丙啶16与18可以很容易由廉价的萜类化合物制备。差示扫描量热法(DSC)证明该分子大约在100 ℃开始分解,爆炸试验证明了该分子在运输上没有潜在的爆炸危险。DFT计算证实了该分子具有较低的动力学酸性,故而氧杂吖丙啶的去质子化较慢。作者发现,从萘基格氏试剂15出发,可以以50%的收率与氮-氢-氧杂吖丙啶16反应得到2-萘胺17(Scheme 1h);使用位阻更大的18,则产率更高,达到81%(Scheme 1i)。有意思的是,当作者使用16的N-Me类似物19a时,-78 ℃下根本不和萘基格氏试剂15反应,而在室温条件下19a却意外地扮演了氧转移试剂的角色,高效地得到了2-萘酚20(Scheme 1j);使用苄基取代的19b时,则2-萘酚的收率更高,达到86%(Scheme 1k)。
随后,作者对底物的适用范围进行了考察。作者首先对不同取代的芳基格氏试剂的活性进行了研究(Scheme 2 & Scheme 3)。结果表明,不同取代的芳基格氏试剂及芳香杂环格氏试剂都表现出了很好的反应性,与氮-氢-氧杂吖丙啶反应后加入NH4Cl溶液得到芳香胺,反应时间短,条件温和。

Scheme 2. 芳基金属试剂的一级胺化(芳基格氏试剂的结构考察)。图片来源:Nature Chem.

Scheme 3. 芳基金属试剂的一级胺化(芳香与芳香杂环格氏试剂的结构考察)。图片来源:Nature Chem.
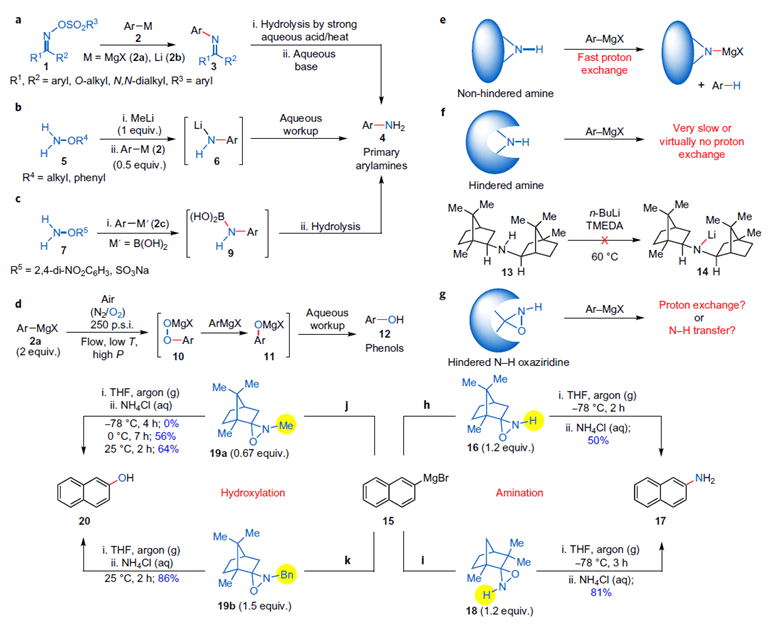
随后,作者考察了不同结构的氮-氢-氧杂吖丙啶反应性(Scheme 4)。研究发现,对于不同的芳基格氏试剂,氮-氢-氧杂吖丙啶(16、18、30、31)表现出了不同的反应活性。
Scheme 4. 芳基金属试剂的一级胺化(氮-氢-氧杂吖丙啶的结构考察)。图片来源:Nature Chem.
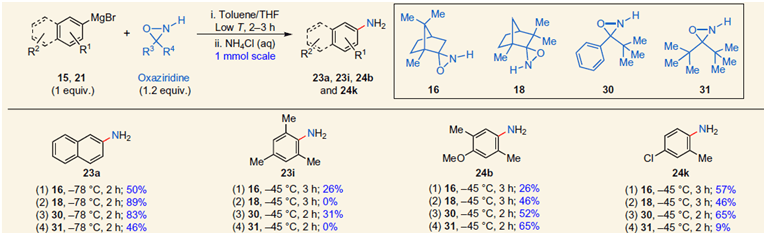
在完成格氏试剂胺化反应的研究后,作者再使用氮-苄基-氧杂吖丙啶19b作羟基化试剂,考察了不同取代的格氏试剂的反应性(Scheme 5)。研究发现,该反应条件温和、时间短、产率高。
Scheme 5. 芳基格氏试剂的直接羟基化。图片来源:Nature Chem.
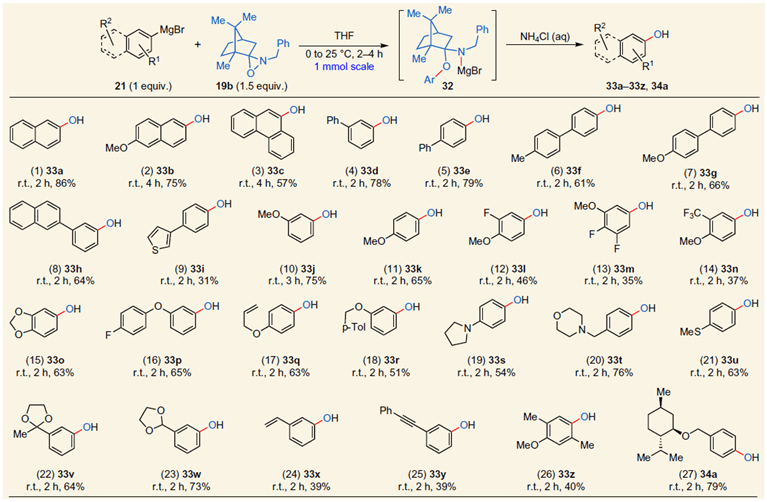
最后,作者还研究了该反应的机理。理论计算表明(PhMgBr)2与氧杂吖丙啶18作用时胺化的自由能垒(TS1)低于质子化的自由能垒(TS2)。同时,与18作用时羟基化的自由能垒(TS3)远高于胺化自由能垒(TS1)。但以氧杂吖丙啶19b为底物与(PhMgBr)2作用时,羟基化的自由能垒略低于胺化自由能垒(约2 Kcal.mol-1)(Scheme 6a)。基于这些结果,作者对胺化反应提出了如下的机理:格氏试剂21a进攻氧杂吖丙啶18中亲电性的氮,N-O开环生成中间体22a,β-消除得到萘胺镁盐和葑酮,萘胺镁盐经NH4Cl或水处理后得到产物23a(Scheme 6b)。同时,作者进行了氘代实验的研究。没观察到35,说明格氏试剂21b除了与18反应生成胺化产物23b外,在该温度下可迅速发生N-H质子化而得到副产物36(Scheme 6c)。
Scheme 6. a) 胺化、质子转移、羟基化过渡态的研究;b) 可能的机理;c) 氘代实验。图片来源:Nature Chem.
Kürti教授在接受采访时说,“我们的方法真的很简单,加入氧杂吖丙啶,再挑好需要的芳基格氏试剂,芳基胺或酚类化合物就合成出来了。”他指出,这一方法试剂廉价易得,反应温度低,不需要特殊的反应设备、催化剂及配体,底物兼容性还很不错。未来,Kürti教授希望能有试剂生产商可以在市场上供应氧杂吖丙啶,这样化学家们就能更容易使用这一方法,来创造自己想要的氨基或羟基取代的芳香环结构。据说,某知名试剂公司已经开始和Kürti教授实验室进行合作了,或许不久之后大家就能从市场上买到。
原文(扫描或长按二维码,识别后直达原文页面):

http://www.nature.com/nchem/journal/vaop/ncurrent/full/nchem.2672.html
Rapid heteroatom transfer to arylmetals utilizing multifunctional reagent scaffolds
Nature Chem., 2016, DOI: 10.1038/nchem.2672
C&EN 报道:
http://cen.acs.org/articles/94/i48/Teaching-aryl-Grignards-new-synthetic.html
研究团队介绍
László Kürti博士
http://www.x-mol.com/university/faculty/3167
Daniel H. Ess博士
http://www.x-mol.com/university/faculty/5067
高洪银博士(现为山东大学教授)
http://www.x-mol.com/university/faculty/26804
http://www.chemnew.sdu.edu.cn/tea-165.html
(本文由ChemHP供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号