《Nature》:如何让你的芳香化合物轻松“咻”到18氟(十八福)
芳香亲核取代反应(nucleophilic aromatic substitution,SNAr)是有机化学家广泛使用的一种对芳香化合物进行官能团化的方法,也是一种常用的生成含氟芳烃的方法,而含氟芳烃在药物化学和材料化学中具有重要作用(我们将在之后的综述中详细介绍,敬请期待)。通常的SNAr中,亲核试剂在进攻带有离去基团的碳原子时,产生一个带有负电荷的中间体,称为Meisenheimer中间体,只有那些带有吸电子基的芳烃才可以有效地稳定的负电荷集聚的Meisenheimer中间体,这就限制了SNAr反应的范围,例如普遍存在的邻对位带有强的π-受体的芳香化合物就不能有效地发生SNAr反应。
近期,哈佛大学化学系的青年化学家、有名的氟(福)将Tobias Ritter教授在《Nature》上报道了一种让化合物变得有氟(福)的新方法——协同的芳香亲核取代反应(concerted nucleophilic aromatic substitution,CSNAr),不经历Meisenheimer中间体,底物也就不局限于缺电子芳烃。通过对反应机理的探究,作者发展了一种氟离子对于酚类化合物的脱氧氟化反应,不仅可以得到19F的氟代产物,还可以得到放射性同位素18F的氟代产物。后者在医学上具有重要应用,可用来合成含有18F的正离子发射断层扫描positron-emission tomography(PET)探针分子。这种方法从简单的酚类底物出发,不需要进行繁琐的共沸干燥,可以简捷地合成常规氟化方法不能实现的含氟芳香化合物。(Concerted nucleophilic aromatic substitution with 19F− and 18F−. Nature, DOI: 10.1038/nature17667)

图1. Tobias Ritter教授。图片来源:Harvard University
从反应机理来看,SNAr反应要么经过加成消除的过程,经历Meisenheimer中间体,要么经过消除加成的过程,经历苯炔中间体,但都需要较高的活化能。尤其是加成消除的过程也就是σ*途径,不像一般的SN2反应,这里苯环和离去基团形成的σ*轨道被苯环屏蔽,使得反应几乎不可能发生(图2a)。而在协同的芳香亲核取代反应(CSNAr)中,作者利用自己发展的Pheno Fluor试剂和酚类底物发生脱氧氟化反应,过渡态能量比SNAr过程的能量降低,并且减少了过渡态中电荷的集聚,使得富电子芳烃都可以发生CSNAr反应。
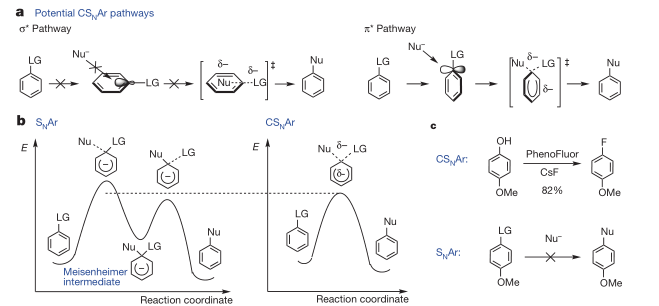
图2. SNAr和CSNAr反应中轨道相互作用和能量分布的比较。图片来源:NPG
作者对反应机理进行了详细的探究,苯酚和PhenoFluor先发生作用生成脲中间体1和HF2- 负离子,再在外加入的CSF作用下,生成含氟的四面体中间体2,经由协同过程,发生脱氧氟化反应,生成氟代苯和脲化合物3。作者也通过DFT计算,得出过渡态和最终产物之间的能量差为21.8 ± 0.2 kcal mol −1。在碳氧键断裂的决速步中,16O和18O的一级动力学同位素效应是一致的。在一些特定底物中,区域选择性地生成了氟代产物,也排除了苯炔中间体的过程。综上实验结果,可以断定,酚类底物的脱氧氟化反应确实是经由协同的芳香亲核取代反应发生的。
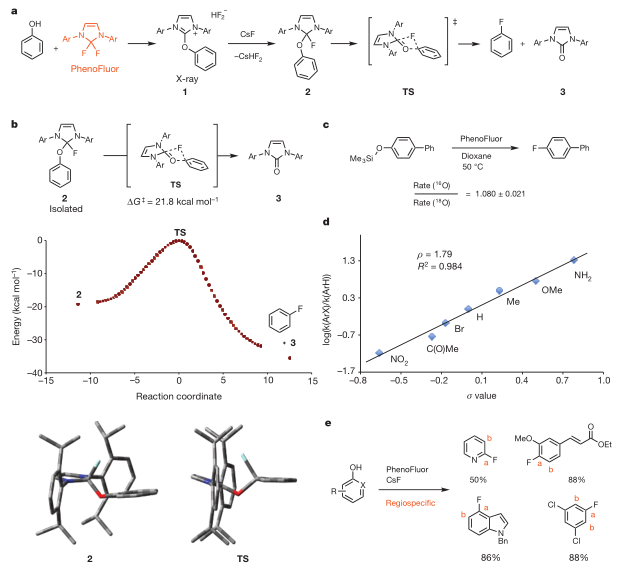
图3. PhenoFluor介导的脱氧氟化反应的机理研究。图片来源:NPG
作者也通过一系列的对照实验探究了氟化反应的详细过程,酚类底物和Pheno Fluor先发生作用后,加入CSF或者不加都可以生成脱氧氟代的产物,但产率相差甚大,显然是经历了不同的反应机理,可见外在氟源的加入是非常必要的(图4a)。但当加入的氟离子没有和脲中间体1或者含氟四面体中间体2发生离子交换,也同样得不到氟代产物。而即使当苯酚和氯代物的盐4发生作用后,得到脲中间体5,只要在阴离子交换器中发生离子交换,同样可以通过含氟四面体中间体得到氟代产物,还可以得到18F的氟代产物。而18F的负离子是经质子轰击18O-的H2O产生的,进而被离子交换器捕获就可以得到。
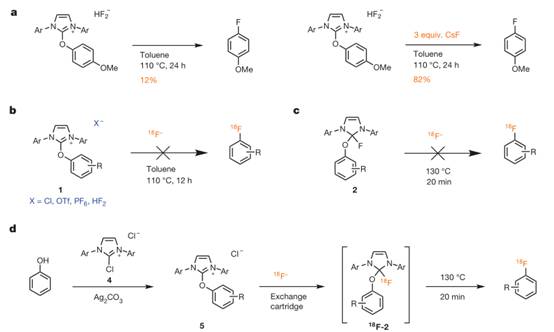
图4.放射性同位素18F的引入。图片来源:NPG
作者也尝试了底物范围的扩展,绝大多数酚类、取代的酚类以及含有杂原子的酚类等都可以和氯代物的盐4发生作用后,在离子交换器中发生离子交换,通过含氟四面体中间体得到18F的脱氧氟代产物。产率中等到良好,表现出了良好的官能团容忍性,胺基、氰基、醛基、酰胺甚至裸露的酚羟基等都可以兼容,但羧酸类底物是不能发生氟代反应的,因为羧酸会阻止脲中间体5的生成。
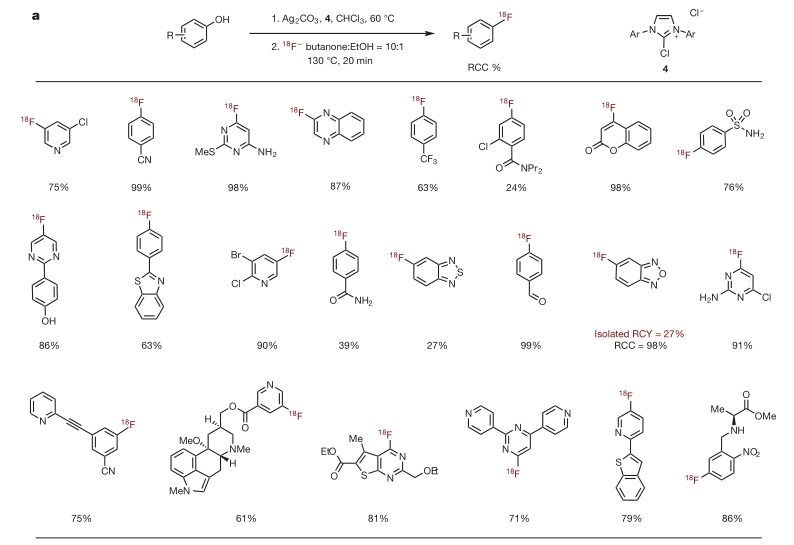
图5.脱氧氟化反应底物的扩展。图片来源:NPG
综观全文,哈佛大学化学系的氟(福)将Tobias Ritter教授报道的这种全新的让化合物变得有氟(福)的方法——氟离子的协同芳香亲核取代反应(CSNAr),既可以得到19F的氟代产物,还可以轻松“咻”到18F,得到放射性同位素18F的氟代产物。反应操作简便,底物适用性广泛,官能团容忍性好,许多底物都取得了良好到优秀的产率。作者还对反应机理进行了详细的研究。这不仅是氟化学领域的又一重大突破,还将在药物化学中发挥重要的作用。
http://www.nature.com.edgesuite.net/nature/journal/vaop/ncurrent/full/nature17667.html
Tobias Ritter课题组主页:http://rittergroup.org/tobias.html
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号