非酶酰化转移拆分催化剂研究进展
酰化转移类拆分反应最早可追溯到上世纪30年代[1]。在早期的研究中,人们通常使用天然存在的生物碱作为催化剂,如(-)-马钱子碱、(+)-奎尼定。到了20世纪90年代,有人使用人工合成的手性叔胺作为催化剂获得了大约45%e.e.值的产物。
1996年,Vedejs等人首次报道使用C2-对称的磷化合物或双环体系磷化合物可取得高选择性(s>10)[2]。自此,催化不对称酰化反应领域进入了飞速发展阶段,一系列优良的催化剂相继问世,主要包括磷类、氮类亲核性小分子催化剂。这些小分子催化剂具有价格低廉、反应条件温和、易于储藏、无金属污染、催化活性高等酶和金属催化剂所不具备的优点。下面将逐一介绍各类小分子酰化转移催化剂。
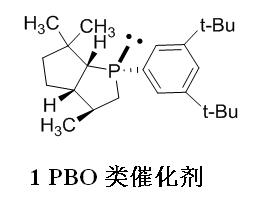
1)双环磷催化剂
Vedejs等人[2-7]报道的磷催化剂可以拆分底物有芳基烷基仲醇[2-6]、烯丙醇[7]。但与其他催化剂相比,对环醇的拆分s值较低(最大s值为3.2)[2],而对芳基烷基仲醇和烯丙醇在低温下拆分往往可获得满意的反应立体选择性。
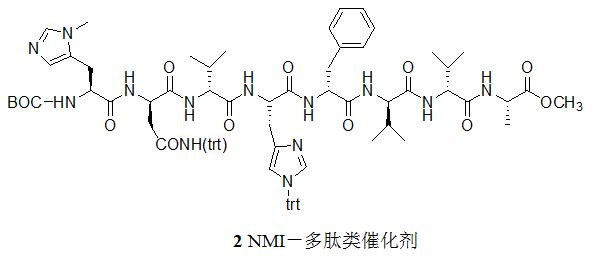
2)NMI-短肽类催化剂[8-14]
近些年,Miller等人发展了一系列含有氮-烷基咪唑(NMI)的多肽催化剂[8-14],这一系列催化剂的潜力在于多肽模型化的结构和已经成熟的多肽组装方法使得人们可以快速地合成结构多样的候选催化剂。
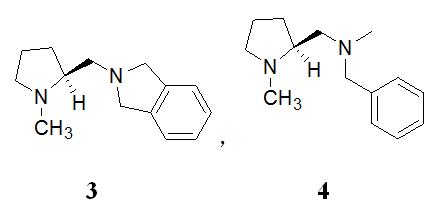
3)脯氨酸类催化剂[15-17]
Oriyama等人发展的(S)-脯氨酸衍生的二氢异吲哚类手性二胺[15-17],用于外消旋环己醇的手性拆分。
4)DMAP类催化剂
自1996年,Vedejs和Chen小组[18-19]首次将手性引入传统催化剂4-(二甲基氨基吡啶)吡啶(DMAP)(5,6),并成功拆分含芳香基团的仲醇后(s>10),该领域发展迅速。一系列基于DMAP结构的催化剂相继出现:包括二茂铁类催化剂[20-22]、轴手性类催化剂[23-26]、构型转换类催化剂[27-28]等。
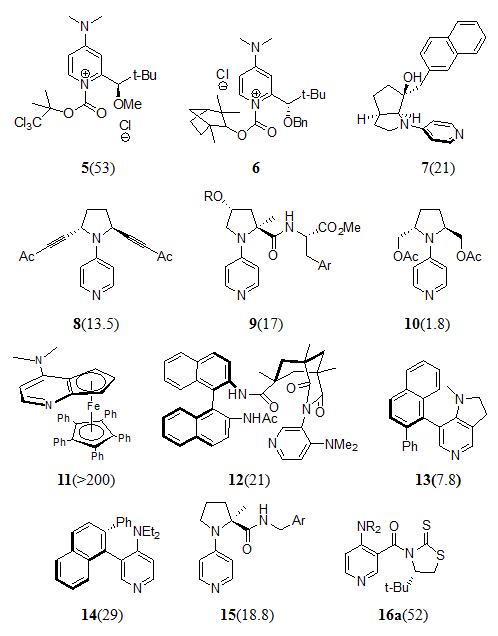
图 1 DMAP衍生的催化剂(括号内为文献报道的拆分最大s值)
在图 1所示的众多催化剂中,最优异的催化剂为Fu[9]等人报道的二茂铁类催化剂11。二茂铁类催化剂11可拆分芳基烷醇、环烷醇、炔丙醇、烯丙醇等底物,也用于外消旋的二醇动力学以及内消旋二醇的去对称化。但目前需要采用半制备级手性固定相拆分来制备该类催化剂,在增加成本的同时也制约了该类催化剂的发展。
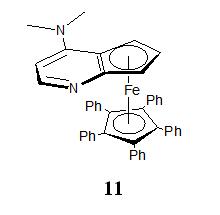
5)2,3-二氢咪唑类催化剂[29-34]
Birman等人报道的以2,3-二氢咪唑并[1,2-α]吡啶17a为核心的手性二胺类化合物[31],是一类适用于芳基仲醇拆分的催化剂。在17a基础上开发出的第二代催化剂18能进一步提高拆分反应的速度和立体选择性[33],以α-叔丁基苯甲醇为例,拆分反应的对映选择性因子s值高达117。利用最近开发出的四咪唑型手性催化剂19a拆分外消旋1-邻甲苯基乙醇,s值达到了355[29]。
上述所提各种催化剂中,拆分效率可与酶相匹敌的有双环磷催化剂1、二茂铁催化剂11、苯并四咪唑催化剂19a。双环磷催化剂1在-40℃下,对1-(2,4,6-三甲基苯)乙醇的拆分s值可达到390[6];二茂铁催化剂11在0℃下,对1-(2,4-二甲基苯)乙醇的拆分s值达到200以上[22];苯并四咪唑催化剂19a在0℃下,对1-邻甲基苯乙醇的拆分s值达355[29]。
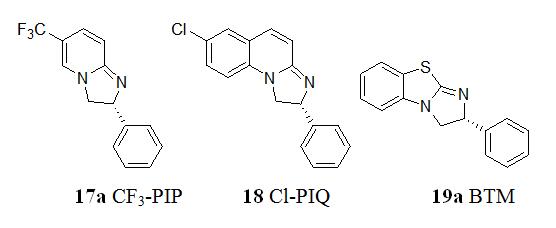
在催化剂的合成路线上,以苯并四咪唑催化剂19a的合成路线最为简短。其中原料D-苯甘氨醇和2-氯苯并噻唑成本低廉,均可从市场上大量购买到,苯并四咪唑催化剂19a的手性直接来源于手性原料D-苯甘氨醇;二茂铁类催化剂11的手性来源于最后一步的色谱拆分或化学重结晶拆分,不仅工艺繁杂,成本提高,收率也被限制在50%以下;双环磷催化剂1在合成过程中涉及到多步不对称底物诱导反应[6],及不稳定中间体,反应步骤长,这些都导致催化剂1的合成成本提高,制约了该类催化剂的发展。
在拆分底物谱上,又以苯并四咪唑催化剂19a和二茂铁催化剂11的底物谱最广,目前报道的非酶催化剂的仲醇底物谱有芳基烷基仲醇、炔丙醇、烯丙醇、环醇。苯并四咪唑催化剂19a和二茂铁催化剂11对上面四类底物均达到较好的拆分效果。
苯并四咪唑催化剂19a [31]的催化机理是催化剂被酰化后形成氮阳离子(图 2),该阳离子和底物分子的芳基之间形成Cation-л相互作用,利用位阻效应控制反应的立体选择性。
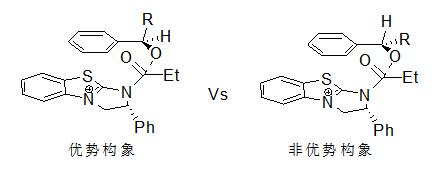
图2 催化剂19a 的催化机理
参考文献:
1. Dalko, P. I., Moisan,L., Angew. Chem. Int. Ed., 2004, 43(39), 5138-5175.
2. Vedejs, E. O.,Daugulis. O., Diver, S. T., J. Org. Chem., 1996, 61(2), 430-431.
3. Vedejs.E., Daugulis. O., Tuttle. N., J. Org. Chem., 2004, 69(4), 1389-1392.
4. Vedejs.E., Daugulis. O., J. Am. Chem. Soc., 1999, 121(24), 5813-5814.
5. Vedejs,E., Dauglis.A., J. Org. Chem., 2003, 68(13), 5020-5027.
6. Vedejs, E., Daugulis, O., J. Am. Chem. Soc., 2003, 125(14), 4166-4173.
7. Vedejs, E., Mackay, J. A., Org. Lett., 2001, 3(4), 535-536.
8. Jarvo,E.R., Copeland, G. T., Papaioannou, N., Bonitatebus, P. J., Miller, S. J., J. Am. Chem. Soc., 1999, 121(50), 11638-11634.
9. Vasbinder, M. M., Jarvo, E. R., Miller, S. J., Angew. Chem. Int. Ed, 2001, 40(15), 2824-2827.
10. Fierman, M. B., O’Leary, D. J., Steinmetz, W. E., Miller,S. J., J. Am. Chem. Soc., 2004, 126(22), 6967-6971.
11. Copeland, G. T., Jarvo, E. R., Miller, S. J., J. Org. Chem., 1998, 63(20), 6784-6785.
12. Copeland, G. T., Miller, S. J., J. Am. Chem. Soc., 2001, 123(27), 6496-6502.
13. Jarvo, E. R., Evans, C. A., Copeland, G. T., Miller, S.J.,J. Org. Chem., 2001, 66(16), 5522-5527.
14. Copeland, G. T., Miller, S. J., J. Am. Chem. Soc., 1999, 121(17), 4306-4307.
15. Terakado, D., Koutaka, H., Oriyama, T. Tetrahedron: Asymmetry, 2005, 16(6), 1157-1165,.
16. Oriyama, T., Hori, Y., Imai, K., Sasaki, R., Tetrahedron Lett, 1996, 37(47), 8543-8546.
17. Sano, T., Imai, K., Ohashi, K., Oriyama, T., Chem. Lett, 2003, 28(3), 265-266.
18. Vedejs,E., Chen, X., J. Am. Chem. Soc., 1996, 118(7), 1809-1810.
19. Vedejs,E., Chen, X., J. Am. Chem. Soc., 1997, 119(10), 2584-2585.
20. Ruble, J. C., Tweddell, J., Fu, G. C., J. Org. Chem., 1998, 63(9), 2794-2795.
21. Ruble, J. C., Latham, H. A., Fu, G. C., J. Am. Chem. Soc., 1997, 119(6), 1492-1493.
22. Fu,G. C., Asymmetric catalysis with "planar-chiral"derivatives of 4-(dimethyl -amino)pyridine, Acc. Chem. Res., 2004, 37(8), 542-547.
23. Spivey, A. C., Arseniyadis, S., Fekner, T., Maddaford,A., Leese, D. P., Tetrahedron, 2006, 62(2-3), 295-301.
24. Spivey, A. C., Leese, D. P., Zhu, F., et.al, Tetrahedron, 2004, 60(20), 4513-4525.
25. Spivey, A. C., Fekner, T., Spey, S. E., J. Org. Chem., 2000, 65(10), 3154-3159.
26. Spivey, A. C., Fekner, T., Spey, S. E., Adams, H., J. Org. Chem., 1999, 64(26), 9430-9443.
27. Kawabata, T., Nagato, M., Takasu, K., Fuji, K., J. Am. Chem. Soc., 1997, 119(13), 3169-3170.
28. Kawabata, T., Yamamoto, K., Momose, Y., Yoshida, H.,Nagaoka, Y., Fuji, K., Chem. Commun., 2001, (24), 2700-2701.
29. Birman, V. B., Li, X., Org. Lett., 2006, 8(7), 1351-1354.
30. Birman, V. B., Li, X., Jiang, H., Uffman, E. W., Tetrahedron, 2006, 62(2-3), 285-294.
31. Birman, V. B., Uffman, E. W., Jiang, H., Li, X., Kibane,C. J., J. Am. Chem. Soc., 2004, 126(39), 12226 -12227.
32. Birman, V. B., Guo, L., Org. Lett., 2006, 8(21), 4859-4861.
33. Birman, V. B., Jiang, H., Org. Lett., 2005, 7(16), 3445-3447.
34. Birman, V. B., Li, X., Org. Lett., 2008, 10(6), 1115-1118.
(本文由 Katherinezhou 供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号