镍催化非活化烯烃的分子间碳羰基化反应
烯烃是一类廉价易得且应用广泛的化工原料。近年来,利用过渡金属催化实现烯烃选择性官能化构建相应的复杂分子受到科学家的广泛关注。但是,由于非活化烯烃的弱极化性,该反应存在反应活性和选择性等方面的诸多挑战。发展新的催化体系实现高效、高选择性非活化烯烃的双官能化具有十分重要的意义和前景。
酮类化合物是一类广泛存在于医药、农药和天然产物中的重要结构单元,也是一类重要的有机合成中间体。利用简单易得的原料发展高效的酮类化合物的构建方法一直是有机化学的研究热点。过渡金属催化烯烃的碳酰化反应是构建酮类化合物的重要方法之一。但是,由于金属羰基类中间体易发生脱碳反应,目前报道的烯烃碳酰化反应只限于单组分和少数双组分反应模式,多组分反应模式鲜有报道。
最近,东华大学的储玲玲(点击查看介绍)课题组利用弱相互作用导向的镍催化自由基接力还原偶联策略,成功实现了非活化烯烃的三组分碳酰化反应。该方法利用自由基加成到烯烃形成烷基自由基,随后与酰基镍发生交叉偶联,一步高效构建两个碳-碳键,同时利用烯烃底物的弱导向基团实现了优秀的化学选择性和区域选择性。该反应条件温和,具有优异的底物适用性。这一成果近期发表在Nature Communications 上。
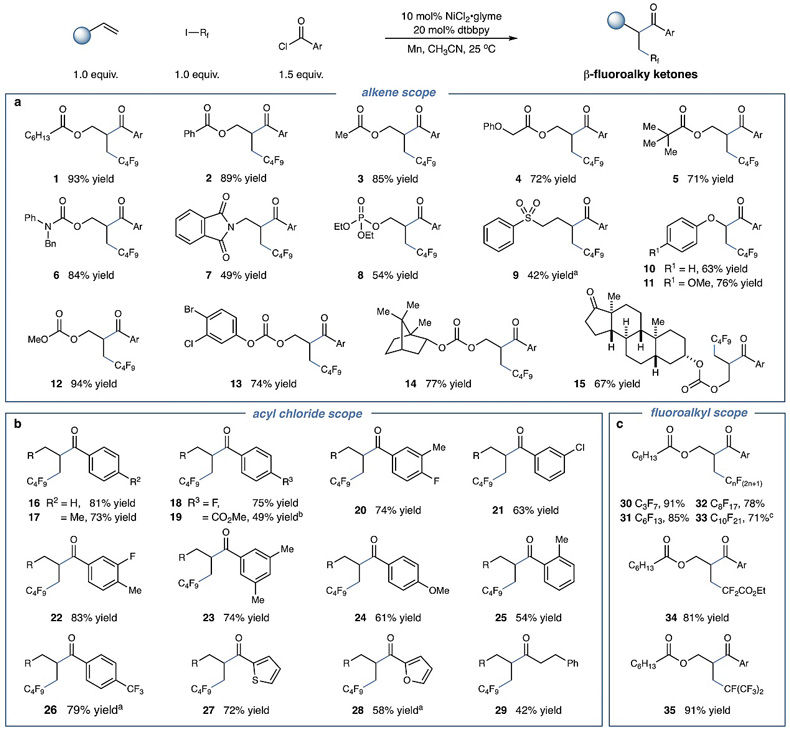
图1. 底物适用范围的考察。图片来源:Nat. Commun.
接下来,作者进一步对导向基团的作用进行了研究,发现当导向基团螯合为六元环和七元环时,该反应的反应性较好,当导向基团螯合成更大或更小环,或者无螯合作用,该反应的反应性显著降低。在此基础上,作者利用导向基团的调控作用,实现了含多烯烃底物的优秀化学选择性。

图2. 导向基团和化学选择性的探究。图片来源:Nat. Commun.
总结
储玲玲课题组利用弱相互作用导向的镍催化自由基接力还原偶联策略,成功实现了非活化烯烃的三组分碳酰化反应。该反应条件温和,具有优异的底物适用性,复杂药物分子和天然产物等衍生物也能高效发生转化。利用这种新颖的催化方法,人们可以从简单易得的原料出发合成一系列重要的氟烷基酮化合物。该方法为非活化烯烃的选择性官能化提供了新的设计思路。相关研究得到国家自然科学基金、上海市青年英才扬帆计划和东华大学启动经费等的大力支持。
该论文作者为:Xian Zhao, Hai-Yong Tu, Lei Guo, Shengqing Zhu, Feng-Ling Qing & Lingling Chu
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Intermolecular selective carboacylation of alkenes via nickel-catalyzed reductive radical relay
Nat. Commun., 2018, 9, 3488. DOI: 10.1038/s41467-018-05951-6
储玲玲博士简介
储玲玲,2007年-2012年就读于中国科学院上海有机化学研究所,师从卿凤翎研究员,获博士学位;2013年-2016年在美国普林斯顿大学化学系David. W. C. MacMillan课题组从事博士后研究;2016年9月加入东华大学,任特聘研究员、博士生导师。到目前为止,储玲玲博士在有机氟化学、可见光催化、过渡金属催化等研究领域以第一作者或通讯作者发表了SCI论文18篇(Acc. Chem. Res.、J. Am. Chem. Soc.、Nat. Commun.、Angew. Chem. Int. Ed.等)。11篇论文被评为所在领域的高被引论文,相关研究成果得到C&EN、Science 等专题报道。2017年,储玲玲博士荣获上海市自然科学技术奖一等奖(排名第二)。
http://www.x-mol.com/university/faculty/49972
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号