由大变小:卟啉脂质体囊泡的演绎历程
越来越多的科学家喜欢将纳米结构的材料或者单体分子结合成更大的超分子结构。这样做的好处在于尺寸较大的材料由于EPR效应(enhanced permeability and retention effect)更易于在肿瘤组织处聚集,从而可以得到更好的成像诊断和疾病治疗效果。但是大尺寸的材料也有自己的问题,它们聚集在肿瘤组织处,难以渗透到肿瘤细胞深处。加拿大多伦多大学马格瑞特公主医院安大略肿瘤研究所的郑岗博士带领他的团队近年来一直致力于研究带卟啉环结构的脂质体纳米囊泡porphysome的性质。现在,就带大家来深扒一下这种porphysome的“演绎历程”吧~~
首先,在2011年,郑岗博士和他的团队制备出了一种由卟啉双分子层自组装形成的纳米囊泡结构。这种纳米囊泡porphysome尺寸大,具有广泛可调性的消光系数、结构依赖性的荧光自淬灭特性和独特的光热和光声特性。构成卟啉双分子层的单体是由两种天然分子(叶绿素和脂质)组成的,然后在尾端通过酰化作用连接上卟啉环分子。并且这种连接键在生物体内是可以被特殊的酶水解,从而被生物体自身代谢掉,毒性很低。在进一步的全身给药的试验中,研究人员还进行了光热切除小鼠体内肿瘤的实验。这项研究发表在2011年的《Nature Materials》上。
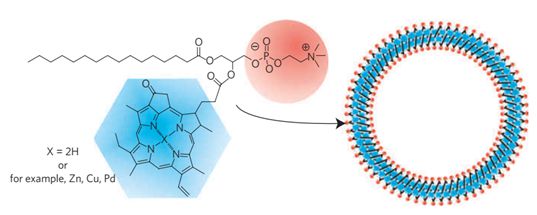
Nat. Mater. 2011 DOI: 10.1038/nmat2986
为了避免大尺寸porphysome在生物体细胞中难以穿透的弱点,郑岗博士带领的研究人员开发出了一种新的方法,将卟啉微囊泡在生物体内转变成纳米尺度,并对肿瘤组织进行多模态成像。他们的工作发表在近期的《Nature Nanotechnology》上。变小后的纳米尺度囊泡因为能穿透更深层次的组织和细胞,反而使得材料的光声成像和光热治疗更具有立体性,治疗效果也变的更好。这个“由大变小”的过程是由低频率超声来实现的。他们利用和上篇文章一样的材料——卟啉双分子层的囊泡结构包裹全氟丙烷气体,其中,卟啉环可以作为光热和光声响应元件,而全氟丙烷气体可以作为超声成像的造影剂。通过换能器产生的低频超声,大的微囊泡(microbubbles,直径大概在2~8mm)被打散成纳米颗粒 (nanoparticles,直径大概在200~300nm)。打散之后的囊泡保持着原有的荧光、光声和光热特性,还能渗透到组织细胞的深处。

Nat. Nanotechnol. 2015 DOI: 10.1038/nnano.2015.25
郑岗博士形容这样的囊泡是“颜色缤纷的水气球”,可以通过它将装载的药物导入到肿瘤中进行靶向治疗。而且根据卟啉的特殊性质,还可以进行光声成像生成高分辨的图像用于寻找和靶向肿瘤,再借助光热将肿瘤杀死。
最后,再补充一篇相关的研究报道。纽约州立大学一个课题组2014年在《Nature Communications》发表文章,指出了郑岗团队制备的porphysome不够稳定,无法在没有胆固醇的作用下稳定运输和装载药物。这个课题组的研究表明这种现象的原因是由于烷基链的一边要长于卟啉环的一边而造成的分子自组装时的不平衡,所以他们进一步在卟啉环上连接了一条含六个碳的碳链。相关实验证明改进后自组装的纳米囊泡不仅可以稳定装载运输药物,而且其生物相容性更好,不仅其基本性质和细胞膜磷脂层相似,而且还可以任意融进细胞膜的磷脂双层中。
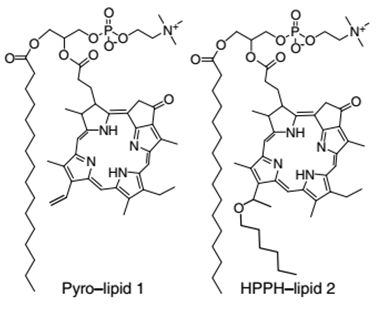
Nat. Commun. 2014 DOI: 10.1038/ncomms4546
(本文由 Anino 供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号