有机化学“颠覆性”成果登Nature封面:SN1 反应的手性之路
饱和碳原子的亲核取代反应是有机化学中最经典的反应之一,通常指连接在饱和碳原子上的某一原子或基团被亲核试剂的另一原子或基团取代的过程。早期的研究发现,有些亲核取代反应的速率取决于卤代烷烃(RX)与亲核试剂(Nu)的浓度,动力学上为二级反应,而有些反应的速率仅与RX浓度有关,动力学上为一级反应。为了解释这一现象,科学家提出了两种反应机理,即双分子亲核取代(SN2)机理和单分子亲核取代(SN1)机理。SN2机理是同步过程,Nu从反应物离去基团(LG)的背面进攻与其相连接的碳原子,经历决定反应速率的形式上的五价碳过渡态,随后旧键的断裂与新键的形成同时发生,并得到构型完全翻转的取代产物(图1a)。SN1机理是分步过程,底物首先离解为碳正离子和带负电荷的离去基团,是反应的控速步,随后碳正离子再接受Nu进攻,由于碳正离子中间体具有平面构型,Nu可以均等的几率从平面两侧与其结合,因而理论上会生成“构型保持”与“构型翻转”的等量产物,即外消旋产物(图1b)。通常情况下,中心碳原子取代基多、位阻大的反应物容易发生SN1亲核取代反应,从而构建空间上高度拥挤的碳中心。但是由于碳正离子中间体固有的不稳定性、高反应活性及平面结构,历经SN1过程的反应往往很难控制产物的分布和立体选择性,特别是手性季碳中心立体选择性的调控,一直是悬而未决的难题。

图1. 饱和碳原子的亲核取代反应:SN2机理vs. SN1机理。图片来源:Nature
近日,哈佛大学的Eric Jacobsen教授(点击查看介绍)团队找到了解决该问题的方法。在手性氢键给体催化剂与Lewis酸促进剂的协同作用下,他们在低温条件下捕获了外消旋底物通过SN1反应机制生成高度活泼的三级碳正离子中间体,有效避免了碳正离子中间体的重排、消除等副产物生成,成功实现了反应对映选择性的高水平调控,并合成了一系列具有季碳中心的手性化合物(图1c),相关成果以封面形式发表在Nature 杂志。

图2. 当期封面。图片来源:Nature
事实上,大多数SN1亲核取代反应生成的并不是完全消旋化的产物,例如(-)-2-溴辛烷在水-乙醇的混合溶液中水解时,“构型保持”与“构型翻转”产物的比例为2:1。对此,科学家提出了离子对机理用以解释这一现象,如图3所示,底物按紧密离子对-溶剂分离子-自由离子的可逆过程进行解离,亲核试剂可以在该过程中的任意阶段与底物发生亲核取代反应。由于R正离子与X负离子结合十分紧密,亲核试剂从X负离子的背面进攻可得到“构型翻转”的产物,而亲核试剂进攻溶剂分离子和自由离子时则得到部分或完全消旋化的产物。毫无疑问,如果在图3中的反应平衡加入一种既能识别碳正离子的某一面,又能优先生成紧密离子对的手性阴离子,那么SN1反应中立体选择性控制的难题将迎刃而解。
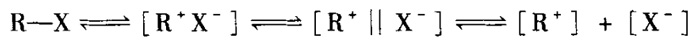
图3. 离子对机理解释SN1反应中的立体化学特征
2017年,Eric Jacobsen教授团队使用手性氢键供体与Lewis酸促进剂相结合的高Lewis酸性复合物作为催化剂,在低温下实现了惰性亲电试剂参与的不对称反应(Science, 2017, 358, 761,点击阅读详细)。在该反应中,手性方酰胺催化剂通过氢键作用攫取三氟甲磺酸硅酯中的OTf-负离子,从而提高三氟甲磺酸硅酯的Lewis酸性,促进缩醛生成活性较高的氧代碳鎓正离子中间体。该正离子中间体与OTf-阴离子-方酰胺络合物形成离子对,并在手性基团的控制下实现亲核试剂对阳离子中间体的对映选择性进攻(图4)。那么,这一策略是否也能成功促进三级碳正离子生成,并将其捕获形成具有手性环境的紧密离子对,进而通过不对称SN1反应构建全取代的手性碳中心呢?

图4. 方酰胺结合三氟甲磺酸硅酯促进惰性亲电试剂参与的不对称反应。图片来源:Science
经过大量的底物考察,作者选择炔丙基乙酸酯2a为四级碳亲电试剂,烯丙基三甲基硅烷为亲核试剂,三氟甲磺酸硅酯TMSOTf为Lewis酸促进剂,在-78 ℃的乙醚溶液中对手性氢键供体催化剂进行了筛选。结果表明,在手性方酰胺1a的作用下,反应不仅能以91%的ee值生成亲核取代的产物3a,消除产物4a的产率也可以控制在5%以下(图5)。

图5. 反应条件的筛选。图片来源:Nature
在最佳的反应条件下,作者对炔丙基乙酸酯与烯丙基三甲基硅烷发生亲核取代反应的底物适用范围进行考察。萘环上的取代基可以是吸电子或给电子基团,反应皆具有优秀的对映选择性和化学选择性。他们发现萘环上对位取代基的Hammett常数(σ+)与反应速率(logVx/VH)呈负线性相关,反应常数ρ为-5.48,表明决速步中反应中心的正电荷密度升高,与SN1反应的机理一致。芳香环的稠合度及取代位点对反应的对映选择性具有较大的影响,芳香环的极化值与对映选择性(log(e.r.))呈正线性相关,表明底物与方酰胺中芳香环间的π-π堆积相互作用有利于提升反应的对映选择性。当炔丙基乙酸酯底物季碳中心附近的立体位阻增大时,反应的对映选择性往往较高。此外,不同杂原子取代的芳香环也能以优异的对映选择性和化学选择性生成目标产物。

图6. 底物适用范围的考察。图片来源:Nature
作者又对亲核取代反应进行了动力学分析,通过原位红外光谱实验对底物不同浓度下的反应速率进行实时跟踪。该不对称反应对炔丙基乙酸酯、烯丙基三甲基硅烷、TMSOTf和方酰胺分别呈一级、零级、次一级和一级动力学特征,表明手性方酰胺与TMSOTf首先快速反应生成稳定态(resting-state)复合物1a-TMSOTf,随后与炔丙基乙酸酯反应生成离子对中间体则是整个过程的决速步骤。

图7. 动力学数据和反应的催化循环。图片来源:Nature
随后作者对亲核取代反应中对映选择性的控制机制进行了研究。通过炔丙基乙酸酯2f和消除产物4a的交叉实验,他们排除了亲核试剂对烯烃副产物发生不对称加成的反应历程(图8a)。炔丙基乙酸酯2f的左旋体与烯丙基三甲基硅烷在两种不同构型1a催化剂的作用下反应1小时后,可以分别生成两种相反构型的亲核取代产物,同时未反应完全的原料(-)-2f仅有微弱程度的消旋化,表明反应中的手性诱导过程经历了非手性碳正离子中间体的对映选择性取代反应(enantioselective substitution reaciton),而非炔丙基乙酸酯发生动态动力学拆分引发立体专一性的取代反应(stereospecific substitution reaciton)(图8b)。12C/13C动力学同位素实验及平衡同位素实验表明,决定手性的关键步骤是不可逆的碳-碳单键形成过程,而不是可逆的碳-碳双键形成过程(图8c)。

图8. 手性控制机理的研究。图片来源:Nature
Eric Jacobsen教授团队通过手性方酰胺氢供体催化剂与Lewis酸结合,成功实现了不对称的SN1亲核取代反应,解决了100多年来制约SN1亲核取代反应发展的世纪难题,并证明了SN1反应中的离子对机理,为全取代碳立体中心的对映选择性构建带来了新的思路和方向。Nature杂志对这项工作给予了高度的评价,并认为这是一项“值得载入有机化学教科书的颠覆性研究成果”。[1]
谈起这项研究,美国特拉华大学的有机合成化学家Mary Watson教授说道:“这是一项漂亮的工作,他们的催化剂不仅能实现高对映选择性的SN1反应,而且还能抑制消除竞争反应发生,注定是化学合成领域的一大进步。”伊利诺伊大学的Christina White教授对该工作也赞赏不已,称Eric Jacobsen教授团队的工作为不对称催化研究开辟了新的领域。[2]
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Quaternary stereocentres via an enantioconvergent catalytic SN1 reaction
Nature, 2018, 556, 447, DOI: 10.1038/s41586-018-0042-1
导师介绍
Eric Jacobsen
http://www.x-mol.com/university/faculty/26725
参考资料:
1.http://naturegraphics.tumblr.com/post/173328712998
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号